题目内容
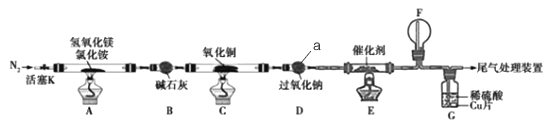
【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |
【答案】 干燥管 Mg(OH)2+NH4Cl![]() MgOHCl+NH3↑+H2O 除去气体中含有的水蒸气(或干燥生成的氨气) 使Na2O2与水蒸气反应生成氧气 铜片逐渐变小,有气泡生成,溶液变蓝色 Cu和Cu2O 0.27 向大试管中加入稍过量2 mol/L的H2SO4溶液,充分反应 溶液中出现蓝色,说明红色固体中含有Cu2O
MgOHCl+NH3↑+H2O 除去气体中含有的水蒸气(或干燥生成的氨气) 使Na2O2与水蒸气反应生成氧气 铜片逐渐变小,有气泡生成,溶液变蓝色 Cu和Cu2O 0.27 向大试管中加入稍过量2 mol/L的H2SO4溶液,充分反应 溶液中出现蓝色,说明红色固体中含有Cu2O
【解析】(1)仪器a的名称是干燥管;(2)根据题意:利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁(MgOHCl),发生的反应为Mg(OH)2+NH4Cl![]() MgOHCl+NH3↑+H2O,碱石灰可以用来干燥氨气,装置B的作用为除去气体中含有的水蒸气(或干燥生成的氨气);装置D的作用是使Na2O2与水蒸气反应生成氧气;(3)装置G中铜片、稀硫酸及氧气反应生成硫酸铜和水,反应的现象为铜片逐渐变小,有气泡生成,溶液变蓝色;(4) 红色物质为Cu或Cu2O或二者混合物,固体质量减少的质量为减少的氧元素的质量,则减少的氧元素质量为14.40g-12.24g=2.16g,而CuO中氧元素质量为
MgOHCl+NH3↑+H2O,碱石灰可以用来干燥氨气,装置B的作用为除去气体中含有的水蒸气(或干燥生成的氨气);装置D的作用是使Na2O2与水蒸气反应生成氧气;(3)装置G中铜片、稀硫酸及氧气反应生成硫酸铜和水,反应的现象为铜片逐渐变小,有气泡生成,溶液变蓝色;(4) 红色物质为Cu或Cu2O或二者混合物,固体质量减少的质量为减少的氧元素的质量,则减少的氧元素质量为14.40g-12.24g=2.16g,而CuO中氧元素质量为![]() ,故红色固体为Cu和Cu2O;设二者物质的量分别为xmol、ymol,则:
,故红色固体为Cu和Cu2O;设二者物质的量分别为xmol、ymol,则: 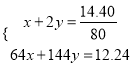 ,解得x=0.09mol,y=0.045mol,则转移电子为
,解得x=0.09mol,y=0.045mol,则转移电子为![]() ;(5)铜能与浓硫酸反应,Cu2O能与稀硫酸反应得到Cu2+,用稀硫酸溶解,溶液变为蓝色,说明红色固体中含有Cu2O,故答案为:
;(5)铜能与浓硫酸反应,Cu2O能与稀硫酸反应得到Cu2+,用稀硫酸溶解,溶液变为蓝色,说明红色固体中含有Cu2O,故答案为:
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2: 向大试管中加入稍过量2 mol/L的H2SO4溶液,充分反应 | 溶液中出现蓝色,说明红色固体中含有Cu2O |

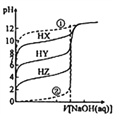
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。