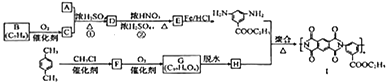
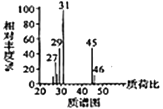
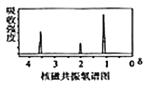
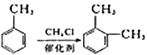
题目内容
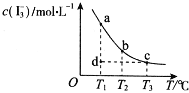
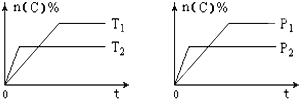
【题目】容积固定的密闭容器中存在如下反应:A(g)+3B(g)![]() 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是
①图I研究的是压强对反应的影响,且乙的压强较高
②图II研究的是压强对反应的影响,且甲的压强较高
③图II研究的是温度对反应的影响,且乙的温度较高
④图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
A. ①② B. ①③ C. ①④ D. ③④
【答案】C
【解析】根据先拐先平的原则,图Ⅰ中乙的速度快,代表乙的压强大于甲。又因为乙在甲的上方,说明压强大,C的浓度更大,即平衡正向移动,题目的方程式是气体物质的量减小的反应,增大压强平衡就应该正向移动,C的浓度增大,①正确。根据先拐先平的原则,若图II研究的是压强对反应的影响,图Ⅱ中甲的速度快,代表甲的压强大于乙。又因为乙在甲的上方,说明压强大,B的转化率更小,即平衡逆向移动,题目的方程式是气体物质的量减小的反应,增大压强平衡应该正向移动,B的转化率增大,②错误。根据先拐先平的原则,若图II研究的是温度对反应的影响,图Ⅱ中甲的速度快,代表甲的温度高于乙,③错误。图Ⅲ中达平衡以后甲乙的压强相同,说明平衡态相同,但是反应的速率不等,甲的速率更快,所以图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高,④正确。

【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
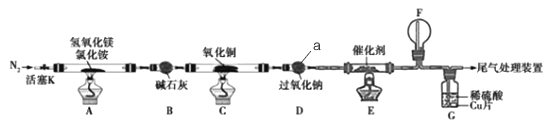
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
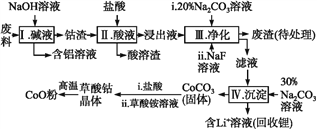
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2和钴的氧化物span>,此过程发生反应的化学方程式为___________。[已知M(CoC2O4·2H2O)=183 g·mol-1]