题目内容
【题目】某化学兴趣小组为了回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡,烧杯内剩余固体27g,求反应中产生气体的质量。___________
【答案】合金中锌的质量的质量为40g-27g=13g
设产生氢气的质量为x
Zn+H2SO4=====ZnSO4+H2↑
65 2
13g x
65:2=13g:x
X=0.4g
答:生成气体的质量为0.4g
【解析】
反应后固体质量不再减少,说明铜的质量是27g,由题中数据可知该合金中铜的质量为27g,则锌的质量为:40g-27g=13g,设生成气体的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
13g x
![]() =
=![]() ,解得:x=0.4g
,解得:x=0.4g
答:生成气体的质量是0.4g。

 应用题作业本系列答案
应用题作业本系列答案【题目】下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温条件下一定能进行
C.NaOH固体溶于水是放热反应
D.A+B=C+D是放热反应,说明A和B物质的总能量高于C和D的总能量
【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,我国首创利用氢氧化镁与氯化铵热分解制氨气并得到碱式氯化镁的工艺。某科研小组根据该原理设计了如图实验装置制备碱式氧化镁并探究氨的还原性,反应前,装置C中CuO的质量为14.40g。
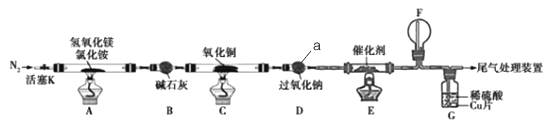
请回答下列问题:
(1)仪器a的名称是_______.
(2)装置A中发生反应的化学方程式为____________,装置B的作用是_________,装置D的作用是________
(3)装置G中的现象为____________
(4)反应结束后装置C中的氧化铜完全反应生成红色固体,并测得其质量为12.24g。则红色固体是______(填化学式),该反应中转移电子的物质的量为_______mol.
(5)完成下列实验方案,证明装置C中完全反应后得到的红色固体中含有氧化亚铜(供选择的试剂:2mol/L的HNO3溶液、2mol/L的H2SO4溶液、2mol/L的NaOH溶液)。
已知:Cu2O+2H+=Cu2++Cu+H2O.
实验步骤 | 预期现象和结论 |
步骤1取装置C中所得红色固体于大试管中 | ----- |
步骤2:_____________________________ | _______________ |