题目内容
19.下列说法正确的是( )| A. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
分析 A.氯水会氧化I2生成HIO3;
B.起始温度应为混合前酸、碱的温度;
C.润洗后,从滴定管的下口放出;
D.浓硫酸能氧化碘离子生成碘.
解答 解:A.氯水会氧化I2生成HIO3,实验室采用实验室氧化碘离子,故A错误;
B.起始温度应为混合前酸、碱的温度,然后混合后测定最高温度,以此计算中和热,故B正确;
C.润洗后,从滴定管的下口放出,因为下口中可能含有水,否则会导致中和滴定过程中酸浓度降低,故C错误;
D.浓硫酸能氧化碘离子生成碘,所以不能用浓硫酸和NaI混合制取HI,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查氧化还原反应、基本操作等知识点,明确实验原理及基本操作规范性是解本题关键,易错选项是D,注意浓硫酸能氧化HI.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
9.某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl-、SO42-、NO3-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如图实验:
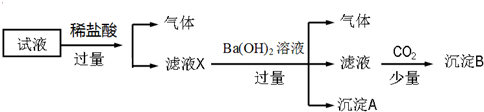
下列说法正确的是( )

下列说法正确的是( )
| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
10.下列各项叙述与结果正确的是( )
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
11.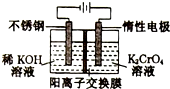 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
8.用NA代表阿伏加德罗常数的数值,下列表述正确的是( )
| A. | 等物质的量的OH-与羟基(-OH)所含电子数相等 | |
| B. | 常温常压下,44 g CO2气体含有氧原子的个数为2 NA | |
| C. | 1 L 0.5 mol•L-1NaHCO3溶液中含有HCO3-的个数为0.5 NA | |
| D. | 11.2 g铁粉与稀硝酸反应转移电子数一定为0.6 NA |
9.某同学设计如下实验测量m g铜银合金样品中铜的质量分数:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 收集到的V L气体都是NO | |
| B. | 过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 | |
| C. | 操作Ⅱ应是洗涤 | |
| D. | 根据题中已知条件不能求出合金中铜的质量分数 |

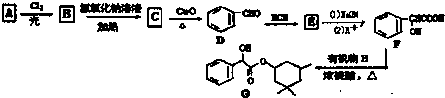
 ,D→E的反应类型为加成反应
,D→E的反应类型为加成反应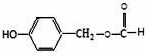
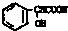 在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式
在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式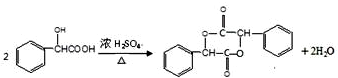
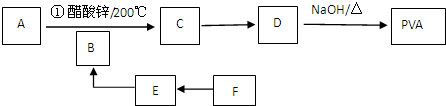
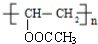 +n NaOH→
+n NaOH→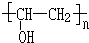 +n CH3COONa.
+n CH3COONa.