题目内容
18.用如图示的方法可以保护钢质闸门.下列说法正确的是( )
| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
分析 A.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,则X为负极发生氧化反应;
B.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,则X为负极,其活泼性大于铁;
C.外加电流的阴极保护法中,被保护的金属作阴极应于电源负极相连;
D.外加电流的阴极保护法中,被保护的金属作阴极发生还原反应.
解答 解:A.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,如果a、b间用导线连接形成原电池,则X作负极发生氧化反应,钢质闸门为正极,故A正确;
B.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,如果a、b间用导线连接形成原电池,则X作负极,其活泼性大于铁,则X可以是锌但不能为石墨,故B错误;
C.外加电流的阴极保护法中,被保护的金属作阴极应于电源负极相连,所以当a、b与外接电源相连时形成电解池,钢质闸门应于电源负极相连作阴极,所以a应连接电源的负极,故C错误;
D.外加电流的阴极保护法中,被保护的金属作阴极发生还原反应,所以当a、b与外接电源相连时,阴极的电极反应式2H++2e-═H2↑,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,涉及金属的腐蚀与防护,明确哪种电极被保护、哪种电极被腐蚀是解本题关键,题目难度不大.

练习册系列答案
相关题目
8.下列各组物质中,属于同分异构体的一组是( )
| A. | 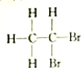 和 和 | B. | 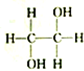 和 和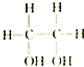 | C. | 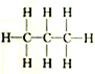 和 和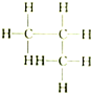 | D. | CH3-CH2-CHO和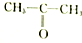 |
9.铊(Tl)与铝同族.Tl3+在酸性溶液中能发生反应:Tl3++2Ag→Tl++2Ag+.下列推断错误的是( )
| A. | Tl+的最外层有1个电子 | B. | Tl能形成+3价和+1价的化合物 | ||
| C. | 酸性溶液中Tl3+比Tl+氧化性强 | D. | Tl+的还原性比Ag弱 |
6.将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
13.下列化学用语正确的是( )
| A. | 聚丙烯的链节:-CH2-CH2-CH2- | B. | 二氧化碳分子的比例模型: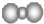 | ||
| C. | 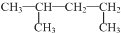 的名称:1,3-二甲基丁烷 的名称:1,3-二甲基丁烷 | D. | 氯离子的结构示意图: |
10.下列说法中,不正确的是( )
| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
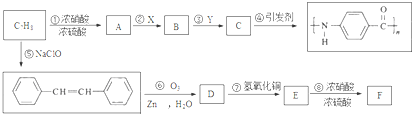
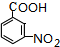 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有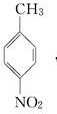 和
和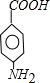 .(填结构简式)
.(填结构简式)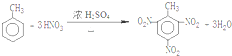 .
.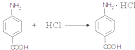 .
.