题目内容
10.下列各组中的分子,全部是以极性键形成的分子是( )| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键.
正负电荷的重心重合,电荷分布均匀,则为非极性分子.
分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A、H2、N2都是由同种原子构成的双原子分子,全部是以非极性键形成的非极性分子,CCl4是以极性键形成的分子,故A错误;
B、CH4、NH3、H2O全部是以极性键形成的分子,故B正确;
C、Cl2是由同种原子构成的双原子分子,只含有非极性键,故C错误;
D、Br2是由同种原子构成的双原子分子,只含有非极性键,故D错误.
故选B.
点评 本题考查了共价键极性的判断,注意根据形成的共价键的原子分析,本题难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
6.10mL某气态烃,在50mL氧气中充分燃烧,得到液态水和35mL气体(气体体积均在同温同压下测定)此烃可能是( )
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
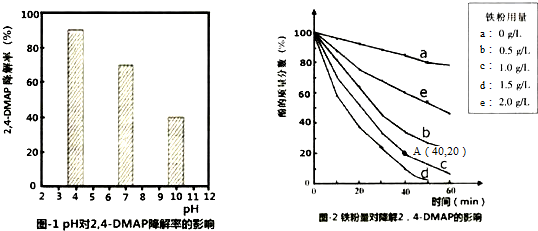
18.利用Na2S2O8产生的强氧化性SO4-•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4-DMAP(2,4--甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |

15.下列有机物命名正确的是( )
| A. | 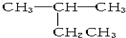 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. |  间二甲苯 间二甲苯 | D. | 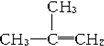 2-甲基-2-丙烯 2-甲基-2-丙烯 |
2.氮化硼是一种新合成的无机材料,它是一种超硬耐磨、耐高温、抗腐蚀的物质.下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间的作用力类型相同的是( )
| A. | 硫酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 苯和四氯化碳 |
20.将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是( )
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
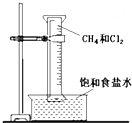 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题: