题目内容
1.工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可采用如下工艺流程: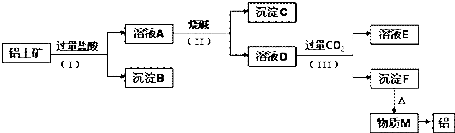
请回答下列问题:
(1)如图中涉及分离溶液与沉淀的实验方法是过滤(填操作名称);
(2)步骤(Ⅱ)中加入的烧碱溶液应该是过量(填“少量”或“过量”),沉淀B的成分是SiO2(填化学式,下同),溶液D中含铝元素的溶质的是NaAlO2,它属于盐(填“酸”、“碱”、“盐”)类物质;
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、FeCl3和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Fe(OH)3,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,由此分析解答.
解答 解:(1)分离难溶物和溶液采用过滤方法,所以图中涉及分离溶液与沉淀的实验方法是过滤,故答案为:过滤;
(2)铝土矿加过量盐酸溶解,Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀B为不溶物SiO2;滤液A中含有的阳离子有Fe3+、Al3+、H+,步骤(Ⅱ)中加入的烧碱溶液是为了将铝分开,故加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀C的成分是氢氧化铁;溶液D中含铝元素的溶质的是AlO2-形成的盐,故答案为:过量;SiO2;NaAlO2;盐;
(3)氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,溶液D中通入过量CO2生成沉淀F,为偏铝酸根离子和二氧化碳能发生反应生成氢氧化铝沉淀;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅清楚提取的操作过程原理,而且需熟知物质间的反应,能熟练对知识迁移进行综合运用是解答的关键,题目难度中等.

| A. | 放电时储氢合金作正极 | |
| B. | 充电时储氢合金作负极 | |
| C. | 充电时阳极周围c(OH-)减少 | |
| D. | 放电时负极反应为LaNi5H6-6e-═LaNi5+6H+ |
| A. | 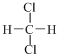 和 和 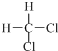 | B. | 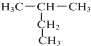 和 和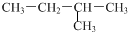 | ||
| C. | CH3CH2CH3和CH2=CHCH3 | D. | 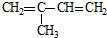 和 和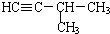 |
| A. | 硅单质广泛用于制作光导纤维 | |
| B. | SO2使氯水褪色,说明SO2具有漂白性 | |
| C. | 氯气泄漏后应顺风向低处跑 | |
| D. | 酸雨的pH值小于5.6 |
| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
| A. | H2O | B. |  | C. |  | D. | H2N-CH2-COOH |
 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.