题目内容
6.10mL某气态烃,在50mL氧气中充分燃烧,得到液态水和35mL气体(气体体积均在同温同压下测定)此烃可能是( )| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
分析 设该烃的分子式为CxHy,根据完全燃烧消耗O2的量,先判断是否完全燃烧,再根据方程式利用差量法计算出满足条件的烃的分子式.
解答 解:四个选项中,C2H6、C4H8、C3H8、C3H6的(x+$\frac{y}{4}$)值分别为3.5、6、5、4.5,10mL完全燃烧需要的氧气的体积分别为35mL、60mL、50mL、45mL,
所以只有C4H8不能完全燃烧,
若完全燃烧,则混合气体是CO2、O2,设烃为CxHy,则
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),体积减小△V
1 1+(x+$\frac{y}{4}$)-x=1+$\frac{y}{4}$
10mL (10+50-35)mL=25mL
则:10mL(1+$\frac{y}{4}$)=25mL×1,
解得:y=6,
即该烃中H原子个数为6,
由于氧气有剩余,所以10(x+$\frac{y}{4}$)<50,结合y=6解得:x<3.5,
所以该气态烃可能为乙烷或丙烯,故A、D正确,C错误;
若不完全燃烧,10mLC4H8完全生成CO需要氧气为:10mL×($\frac{4}{2}$+$\frac{8}{4}$)=40mL,小于50mL,所以混合气体是CO2、CO,设烃为CxHy,根据C原子守恒,有10x=35,解得:x=3.5,碳原子数目应该为整数,不成立,故B错误;
根据分析可知,该烃可能为:A.C2H6、D.C3H6,
故选AD.
点评 本题考查了有机物分子式确定的计算,题目难度中等,试题侧重考查学生分析和解决问题的能力,注意掌握差量法在化学计算中的应用,明确烃的燃烧通式的应用.

 现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:
现用中和滴定法测定某盐酸溶液的浓度,有关数据记录如下:| 实验编号 | 待测液体积/mL | 所消耗氢氧化钠标准液的体积/mL |
| 1 | 25.00 | 26.30 |
| 2 | 25.00 | 26.34 |
| 3 | 25.00 | 19.36 |
(2)现实验室中有石蕊和酚酞两种指示剂,该实验应选酚酞作指示剂,判断滴定终点的现象是滴入最后一滴标准液,溶液由无色变成浅红色,且半分钟内不恢复原来的颜色
(3)下列操作会使所测得的盐酸的浓度偏低的是D.
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数.
试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ②⑦⑧ |
| A. | 放电时储氢合金作正极 | |
| B. | 充电时储氢合金作负极 | |
| C. | 充电时阳极周围c(OH-)减少 | |
| D. | 放电时负极反应为LaNi5H6-6e-═LaNi5+6H+ |
| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
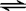 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按如图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.