题目内容
5.现有如下两个反应:A、NaOH+HCl=NaCl+H2O B、2FeCl3+Fe=3FeCl2
(1)根据两反应本质,判断能否设计成原电池的是哪个反应:B;(填A或B)
(2)如果不能设计成原电池,说明其原因(A)的反应非氧化还原反应,没有电子转移;
(3)如果可以设计成原电池,则写出正、负极电极反应式,负极电极反应式Fe-2e-=Fe2+,正极电极反应式2Fe3++2e-=2Fe2+.
(4)利用(3)中反应:设计一个化学电池(给出若干导线,电极材料和电解液自选):
①标出电子流动方向;②注明负极电极材料;③写出电解质溶液.
(5)若该电池外电路中有6.02×1023个电子转移时,则电解质溶液质量增加了28_g.
分析 (1)原电池反应必须是自发进行的放热的氧化还原反应,根据是否有电子转移判断是否能设计成原电池;
(2)原电池反应必须是自发进行的放热的氧化还原反应;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液;
(4)活泼的金属作负极,碳棒作正极,电解质溶液为氯化铁溶液,电子从负极流向正极,要形成闭合回路;
(5)由电极反应式可知Fe-2e-=Fe2+,若导线上转移电子2mol,则电解质溶液增重为56g.
解答 解:(1)原电池反应必须是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,属于复分解反应,不能设计成原电池;(B)中反应前后Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以有电子转移,能设计成原电池,
故答案为:B;
(2)根据(1)知,(A)的反应非氧化还原反应,没有电子转移,所以(A)不能设计成原电池,故答案为:(A)的反应非氧化还原反应,没有电子转移;
(3)负极是活泼的金属,可以用活泼的铁作为负极材料,负极发生氧化反应,电极反应式为:Fe-2e-=Fe2+;正极是不活泼的碳棒,发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;故答案为:Fe-2e-=Fe2+,2Fe3++2e-=2Fe2+;
(4)活泼的金属作负极,碳棒作正极,电解质溶液为氯化铁溶液,电子从负极流向正极,要形成闭合回路,图为: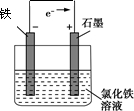 ,故答案为:
,故答案为: ;
;
(5)由电极反应式可知Fe-2e-=Fe2+,若导线上转移电子2mol,则电解质溶液增重为56g,所以外电路中有6.02×1023个电子转移时,即转移1mol的电子,所以电解质溶液增重28g,故答案为:28.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大.

| A. | ①③⑦ | B. | ②⑥⑦ | C. | ①④⑧ | D. | ②⑦⑧ |
| A. | 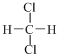 和 和 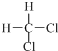 | B. | 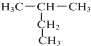 和 和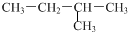 | ||
| C. | CH3CH2CH3和CH2=CHCH3 | D. | 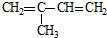 和 和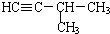 |
| A. | 硅单质广泛用于制作光导纤维 | |
| B. | SO2使氯水褪色,说明SO2具有漂白性 | |
| C. | 氯气泄漏后应顺风向低处跑 | |
| D. | 酸雨的pH值小于5.6 |
| A. | 相对分子质量相同而结构不同的化合物互称为同分异构体 | |
| B. | 分子式相同而结构不同的化合物互称为同分异构体 | |
| C. | 同分异构体之间由于分子组成相同,所以它们的性质相同 | |
| D. | 只有少数的有机物之间存在同分异构现象 |
| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
| A. | SO2 | B. | H2O | C. | HCl | D. | NaOH |
| A. | 碱金属元素随原子序数的递增原子半径逐渐减小 | |
| B. | 碱金属元素随原子序数的递增离子氧化性逐渐减弱 | |
| C. | 碱金属元素的单质在氧气点燃都生成过氧化物 | |
| D. | 碱金属元素随原子序数的递增最高价氧化物对应的水化物碱性逐渐减弱 |