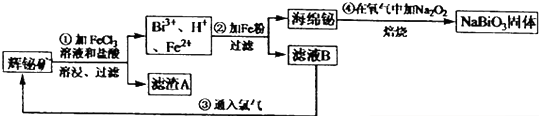
题目内容
12.既能用浓硫酸,又能用碱石灰干燥的气体是( )| A. | Cl2 | B. | SO2 | C. | N2 | D. | NH3 |
分析 浓硫酸具有强氧化性和酸性,能用浓硫酸干燥的气体应不与浓硫酸反应,碱石灰的主要成分为氢氧化钠和生石灰,可与酸性气体反应,以此解答该题.
解答 解:SO2、Cl2能够与氢氧化钠反应,不能用碱石灰干燥,NH3能够与硫酸反应,不能用浓硫酸干燥,
只有N2符合,与浓硫酸和碱石灰都不反应,
故选C.
点评 本题考查了常见气体的净化与干燥,题目难度不大,明确常见气体的性质为解答关键,注意掌握常见干燥剂的组成、类型及选用方法,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
15.下列说法不正确的是( )
| A. | 开发利用太阳能与风能是发展低碳经济的重要途径 | |
| B. | 地沟油对人体危害严重,查证没收后应燃烧处理 | |
| C. | 氮化硅、碳化硅可做耐高温、耐磨材料 | |
| D. | 氯气、臭氧、高铁酸钾都是常用的自来水消毒剂 |
16.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18元素中,满足上述关系的元素共有( )
| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
7.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
17.向25℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是( )
| A. | 1×10-2 mol•L-1 | B. | 1×10-8 mol•L-1 | C. | 1×10-12 mol•L-1 | D. | 1×10-4 mol•L-1 |
1.甲烷在隔绝空气加强热时可分解为C2H2和H2,若有80%CH4按上述形式分解,所得混合气体的密度是相同条件下氢气密度的倍数是( )
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
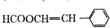 (写结构简式).
(写结构简式).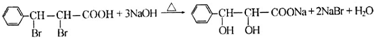
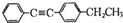 .
.