题目内容
9.下列各式表示水解反应的是( )| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
分析 水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答 解:A、HCO3-+H2O?H3O++CO32-,是碳酸氢根离子的电离方程式,不是水解离子方程式,故A错误;
B、HS-+H2O?H2S+OH-,是硫氢根离子的水解离子方程式,故B正确;
C、H2PO4-+H2O?HPO42-+H3O+,是磷酸二氢根离子的电离方程式,故C错误;
D、HCO3-+OH-?H2O+CO32-,是碳酸氢根离子和氢氧根离子发生的复分解反应,故D错误;
故选B.
点评 本题考查学生对水解反应原理的理解,题目难度不大,明确水解的反应原理是解答本题的关键,注意区分反应、水解和电离.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列说法正确的是( )
| A. | 米酒密封储存变香的过程涉及取代反应 | |
| B. | 甲烷、氯乙烯和硝基苯都属于烃类 | |
| C. | 有机化合物均易燃烧 | |
| D. | 糖类、脂肪和蛋白质在一定条件下都能发生水解反应 |
17.向25℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是( )
| A. | 1×10-2 mol•L-1 | B. | 1×10-8 mol•L-1 | C. | 1×10-12 mol•L-1 | D. | 1×10-4 mol•L-1 |
14.下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
1.甲烷在隔绝空气加强热时可分解为C2H2和H2,若有80%CH4按上述形式分解,所得混合气体的密度是相同条件下氢气密度的倍数是( )
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
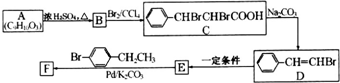
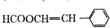 (写结构简式).
(写结构简式).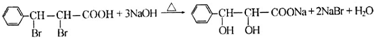
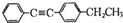 .
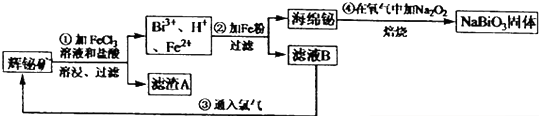
.
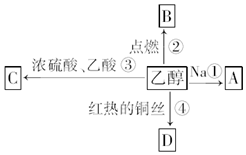 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O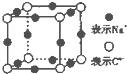 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答: