题目内容
19.用惰性电极电解物质的量浓度相同、体积比为1:3的CuSO4和NaCl的混合溶液,可能发生的反应有( )①2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑
②Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑
③2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
④2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
分析 用惰性电极电解物质的量浓度之比为1:3的CuSO4和NaCl的混合溶液,电解过程分为:
第一阶段,阳极上氯离子放电、阴极上铜离子放电;
第二阶段:阳极上氯离子放电,阴极上氢离子放电;
第三阶段:阳极上氢氧根离子放电,阴极上氢离子放电.
解答 解:用惰性电极电解物质的量浓度之比为1:3的CuSO4和NaCl的混合溶液,设溶液体积为1L,硫酸铜浓度为1mol/L,氯化钠浓度为3mol/L,则n(CuSO4)=n(Cu)=1mol,n(NaCl)=n(Cl-)=3mol,
根据转移电子守恒,第一阶段:阳极上氯离子放电,阴极上铜离子放电,当铜离子完全析出时转移电子的物质的量为2mol,转移2mol电子时析出2mol氯离子,所以氯离子还剩余1mol,则此时发生的电池反应式为②;
第二阶段:阴极上氢离子放电,阳极上氯离子放电,当氯离子完全析出前,发生的电池反应式为③;
第三阶段:阴极上氢离子放电,阳极上氢氧根离子放电生成氧气,所以发生的电池反应式为④;
故选:C.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子相等判断阴阳极上析出的物质,难度中等.

练习册系列答案
相关题目
2. 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )| A. | 电池放电时Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有还原作用 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 每消耗3 mol H2O2,转移的电子为6 mol |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 标准状况下,22.4 L甲苯中含C-H数目为8NA | |
| C. | 常温常压下,3.2 g O2和O3混合物中,氧原子的数目为0.2NA | |
| D. | 0.1 mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |
7.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
9.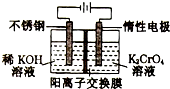 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色 | |
| B. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| C. | 若测得右室中K与Cr的物质的量之比($\frac{nk}{ncr}$)为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比($\frac{nk}{ncr}$)为d,则此时铬酸钾的转化率为2-d |
 .
.