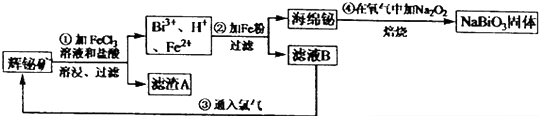
题目内容
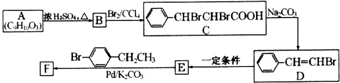
8.由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料,H可以发生银镜反应.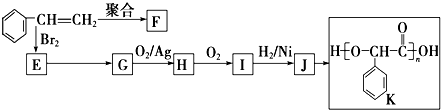
(1)J中所含官能团的名称为羟基、羧基;K中所含官能团的结构简式为-COO-.
(2)聚合物F的结构简式是
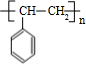 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.(3)E转化为G的化学方程式是
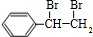 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$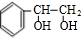 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式
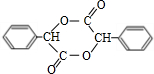 .
.(5)写出J的一种符合下列条件的同分异构体X的结构简式
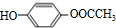 或
或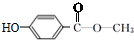 .
.①X与FeCl3溶液反应显色;
②X分子中氢原子核磁共振氢谱有4个峰.
分析 苯乙烯发生聚合反应生成F,则F的结构简式为 ,苯乙烯与溴发生加成反应生成E,故E为
,苯乙烯与溴发生加成反应生成E,故E为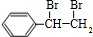 ,由K的结构简式可知,J发生缩聚反应生成K,故J为
,由K的结构简式可知,J发生缩聚反应生成K,故J为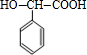 ,E转化得到G,G氧化生成H,H氧化生成I,I与氢气发生加成反应生成J,故G为醇,则G为
,E转化得到G,G氧化生成H,H氧化生成I,I与氢气发生加成反应生成J,故G为醇,则G为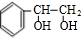 ,H为
,H为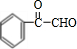 ,I为
,I为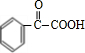 ,据此解答.
,据此解答.
解答 解:苯乙烯发生聚合反应生成F,则F的结构简式为 ,苯乙烯与溴发生加成反应生成E,故E为
,苯乙烯与溴发生加成反应生成E,故E为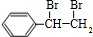 ,由K的结构简式可知,J发生缩聚反应生成K,故J为
,由K的结构简式可知,J发生缩聚反应生成K,故J为 ,E转化得到G,G氧化生成H,H氧化生成I,I与氢气发生加成反应生成J,故G为醇,则G为
,E转化得到G,G氧化生成H,H氧化生成I,I与氢气发生加成反应生成J,故G为醇,则G为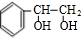 ,H为
,H为 ,I为
,I为 .
.
(1)由上述分析可知,J为 ,含有羟基、羧基,由K的结构简式可知,K中含有酯基,结构简式为-COO-,
,含有羟基、羧基,由K的结构简式可知,K中含有酯基,结构简式为-COO-,
故答案为:羟基、羧基;-COO-;
(2)由上述分析可知,聚合物F的结构简式为 ,I为
,I为 ,分子式是C8H6O3,
,分子式是C8H6O3,
故答案为: ;C8H6O3;
;C8H6O3;
(3)E转化为G的化学方程式是: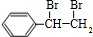 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$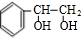 +2NaBr,属于水解反应,
+2NaBr,属于水解反应,
故答案为: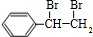 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$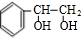 +2NaBr;水解反应;
+2NaBr;水解反应;
(4)在一定条件下,两分子 能脱去两分子水形成一种六元环状化合物,该化合物的结构简式 为:
能脱去两分子水形成一种六元环状化合物,该化合物的结构简式 为: ,
,
故答案为: ;
;
(5) 的一种符合下列条件的同分异构体X:
的一种符合下列条件的同分异构体X:
①.X与FeCl3溶液反应显色,说明含有酚羟基;
②X分子中氢原子核磁共振氢谱有4个峰,可以是苯环上含有2个取代基,另外侧链为-OOCCH3或-COOCH3,且处于对位位置,故符合条件的X的结构简式为: 或
或
故答案为: 或
或 .
.
点评 本题考查有机物的推断与合成,涉及烯烃、卤代烃、醇、醛、羧酸的性质等,掌握官能团的性质是关键,(5)中限制条件同分异构体的书写,为易错点,注意根据题目信息确定含有的官能团.

练习册系列答案
相关题目
18.下列化学用语或物质的性质描述正确的是( )
| A. | 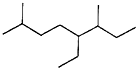 如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 乙烯在一定条件下能发生加成反应,加聚反应,被酸化高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 | |
| D. | 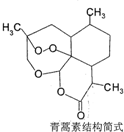 治疗疟疾的青蒿素(如图),分子式是C15H20O5 |
19.已知:CO2(g)+C(s)=2CO(g)△H1
C(s)+H2O(g)=CO(g)+H2(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
CuO(s)+CO(g)=Cu(s)+CO2(g)△H4
2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断不正确的是( )
C(s)+H2O(g)=CO(g)+H2(g)△H2
CO(g)+H2O(g)=CO2(g)+H2(g)△H3
CuO(s)+CO(g)=Cu(s)+CO2(g)△H4
2CuO(s)+C(s)=2Cu(s)+CO2(g)△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1>0 | B. | △H2>0 | C. | △H2<△H3 | D. | △H5=2△H4+△H1 |
16.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18元素中,满足上述关系的元素共有( )
| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05 mol•L-1 Fe2(SO4)3溶液中含Fe3+数目为0.1NA | |
| B. | 标准状况下,22.4 L甲苯中含C-H数目为8NA | |
| C. | 常温常压下,3.2 g O2和O3混合物中,氧原子的数目为0.2NA | |
| D. | 0.1 mol Na2O2与足量CO2反应时,转移的电子数目为0.2NA |
7.下列描述的一定是金属元素的是( )
| A. | 易失去电子的物质 | B. | 原子核外有10个电子的微粒 | ||
| C. | 原子的最外层只有1个电子的元素 | D. | 原子核内有12个质子的元素 |
5.只有在化合物中才能存在的化学键是( )
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键.
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键.
| A. | ①④ | B. | ①②④ | C. | ③⑤ | D. | ①③⑤ |
 (写结构简式).
(写结构简式).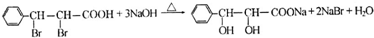
 .
.