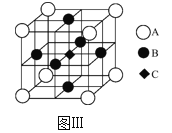
题目内容
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
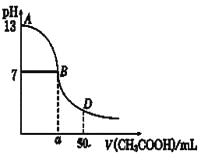
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
【答案】碱式滴定管 甲基橙或酚酞 溶液由黄色变为橙色(红色),且30s内不变为黄色或者溶液由粉红色变为无色,且30s内不变红 96% 偏高 偏低 否 AB =
【解析】
(1)NaOH会与酸式滴定管活塞中的二氧化硅反应生成具有黏性的硅酸钠,使活塞难以打开,故量取NaOH溶液用碱式滴定管;强酸与强碱完全反应时所得溶液呈中性,故酸碱指示剂可选用甲基橙或酚酞;若指示剂选甲基橙,终点现象为:溶液由黄色变为橙色(红色),且30s内不变为黄色;若指示剂选酚酞,终点现象为:溶液由粉红色变为无色,且30s内不变红。
(2)根据表格数据,第3次实验数据误差较大,不参与计算,两次实验消耗盐酸体积的平均值为![]() =24.00mL,根据n(NaOH)=n(HCl),则c(NaOH)×20.00mL=0.1mol/L×24.00mL,解得c(NaOH)=0.12mol/L,样品中NaOH的质量百分含量为=
=24.00mL,根据n(NaOH)=n(HCl),则c(NaOH)×20.00mL=0.1mol/L×24.00mL,解得c(NaOH)=0.12mol/L,样品中NaOH的质量百分含量为=![]() ×100%=96%。
×100%=96%。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,导致消耗盐酸的体积偏大,将使所测结果偏高;若读酸式滴定管读数时,滴定前仰视读数,导致初读数据偏大,滴定后正确读数,消耗盐酸的体积偏小,则所测结果偏低。
(4)①醋酸是弱酸,NaOH是强碱,两者恰好反应生成强碱弱酸盐,溶液显碱性,而B点溶液显中性,不是NaOH与CH3COOH恰好完全反应的点;则恰好反应区间在AB。
②D点是同浓度NaOH 25mL与50mL CH3COOH混合,得到含等物质的量的CH3COOH 与CH3COONa 的混合溶液,根据物料守恒可得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+)。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案