题目内容
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液。此时再向试管中加入少量MnO2粉末,又有气泡产生,该气体能使带火星的木条复燃。
①写出Na2O2在呼吸面具中作供氧剂的两个化学反应方程式__________,__________;
②滴入酚酞溶液后看到的现象是________;
③已知MnO2作为催化剂,则加入MnO2反应的化学方程式为_____;
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下:
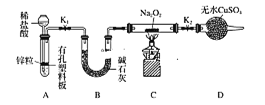
步骤1:按如图组装仪器(图中夹持仪器省略),装入药品。
步骤2:打开K1、K2,产生的气体流经装有Na2O2的硬质玻璃管,一段时间后没有任何现象。
步骤3:开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
(提示:B装置的作用是吸收A装置中挥发的HCl气体和水蒸气。)
①步骤1组装好仪器之后,装入药品之前,应________。
②A装置中添加稀盐酸的仪器名称是_____,A装置中发生反应的离子方程式为______。
③步骤3在点燃C处酒精灯前必须进行的操作是________;④你得到的结论是______ (若能反应请用化学方程式表示);
【答案】2Na2O2+2CO2=2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑ 溶液先变红,后褪色 2H2O2![]() 2H2O+O2↑ 检查装置气密性 长颈漏斗 2H++Zn=Zn2++H2↑ 检验氢气纯度 Na2O2+H2
2H2O+O2↑ 检查装置气密性 长颈漏斗 2H++Zn=Zn2++H2↑ 检验氢气纯度 Na2O2+H2![]() 2NaOH
2NaOH
【解析】
根据过氧化钠的性质书写相关反应方程式;根据物质性质及实验中可能发生的化学反应分析实验现象;根据双氧水的不稳定性分析并书写相关反应方程式;根据实验原理及实验现象得出探究的结论。
(1)①Na2O2在呼吸面具中作供氧剂是和二氧化碳与水分别发生反应生成氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑;
②过氧化钠和水反应生成氢氧化钠,氢氧化钠溶液呈碱性,碱遇酚酞变红,过氧化钠和水反应还会生成的过氧化氢,过氧化氢具有氧化性、漂白性,所以红色会褪去,所以现象为:溶液先变红,后褪色,故答案为:溶液先变红,后褪色;
③过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①实验原理是验证氢气与过氧化钠的反应,所以组装好仪器之后,应检查装置气密性,故答案为:检查装置气密性。
②分析装置图和实验步骤可知,盛盐酸的仪器为长颈漏斗;稀盐酸与金属锌反应生成氯化锌和氢气,离子方程式为:2H++Zn=Zn2++H2↑,故答案为:长颈漏斗;2H++Zn=Zn2++H2↑;
③氢气是可燃性气体,混有空气易发生爆炸,步骤3在点燃C处酒精灯前必须进行的操作是:验纯,防止空气与氢气混合加热爆炸;故答案为:检验氢气纯度;
④实验现象分析可知过氧化钠变为白色固体,硫酸铜不变蓝色,证明无水生成,证明氢气和过氧化钠反应生成白色氢氧化钠,反应的化学方程式为:Na2O2+H2![]() 2NaOH,故答案为:Na2O2+H2
2NaOH,故答案为:Na2O2+H2![]() 2NaOH。
2NaOH。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
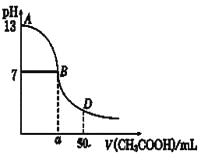
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
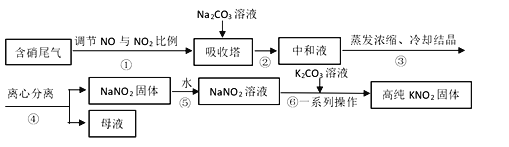
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
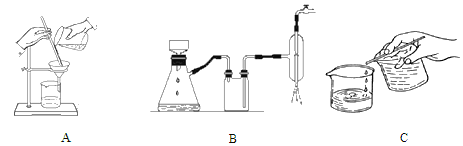
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2