题目内容
【题目】以天然气为原料合成氨是现代合成氨工业发展的方向与趋势
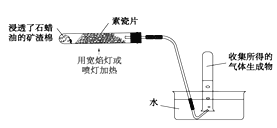
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:
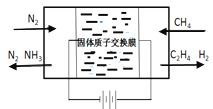
写出在阴极表面发生的电极反应式:_____________。
(二)天然气为原料合成氨技术简易流程如下:

一段转化主要发生的反应如下:
①CH4(g) +H2O(g) ![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g) ![]() 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) ![]() 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能_________。
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数_________。
(3)下列说法正确的是_________。
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:

①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是________。
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线_______。
【答案】N2+6H++6e- = 2NH3 799.5kJ·molˉ1 3.5 BCD 负载量1%时,则负载量过低导致催化活性降低,负载量9%负载量虽高但催化剂的比表面积会降低而使催化活性降低 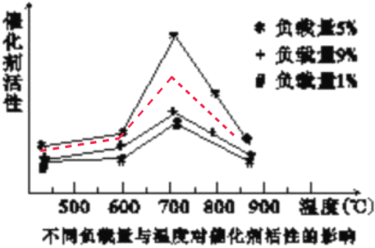
【解析】
(一)与外电源负极相连的为电解池阴极,发生还原反应,装置中N2转化为NH3,所以阴极表面发生的电极反应:N2+6H++6e-=2NH3,故答案:N2+6H++6e- = 2NH3;
(二)(1)根据盖斯定律可知将反应①+②得到:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH =165kJ/mol,ΔH=4E(C-H)+4E(O-H)-2E(C=O)-4E(H-H)=4×414kJ/mol+4×463kJ/mol-2×E(C=O)-4×436kJ/mol=165kJ/mol,可得E(C=O)=799.5kJ/mol,故答案为:799.5kJ/mol;
(2)发生的反应为① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
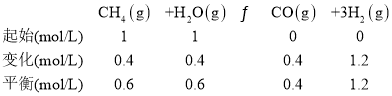
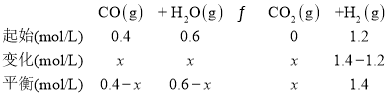
解得x=0.2mol/L。反应②的平衡常数K=![]() =3.5,故答案:3.5;
=3.5,故答案:3.5;
(3)A.合成氨的反应为放热过程,温度升高降低平衡转化率,故A错误;
B.压缩相当于加压,反应向气体分子数减少方向移动,加压有利于反应正向进行,所以上述工业流程中压缩既能提高反应速率又能提高合成氨的产率,故B正确;
C.一段过程主要为吸热过程,二段主要过程为放热过程,因此可以通过传热装置转化释放的热量,可为一段反应转化提供热源,实现能量充分利用,故C正确;
D.二段过程中主要是有O2参加反应,可通过空气来提供反应所需要的O2,但需严格控制空气的进气量,否则会发生其余副反应,破坏合成气中的氢氮比,故D正确;
故答案为:B、C、D;
(4)①负载量较低时,提供催化活性中心的活性位点不足,可能导致催化剂活性不够,负载量过高,催化剂的比表面积会降低,导致催化剂活性中心位点过于拥挤,可能导致空间坍塌影响催化活性,故答案为:负载量1%时,则负载量过低导致催化活性降低,负载量9%负载量虽高但催化剂的比表面积会降低而使催化活性降低;
②负载量为3%小于负载量5%,并且已知负载量1%时活性低于5%负载量,负载量为9%时高于负载量为1%的催化剂活性,但1%的负载量与9%的负载量所体现的催化活性及其接近,可推知低负载量对于催化剂活性的影响较之于高负载量对于催化剂活性的影响更大,则3%负载量的催化剂活性应介于5%与9%之间的负载量之间的活性,所以作图为: ,故答案:
,故答案: 。
。

【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:
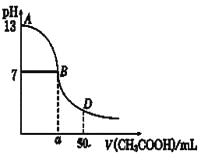
①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)
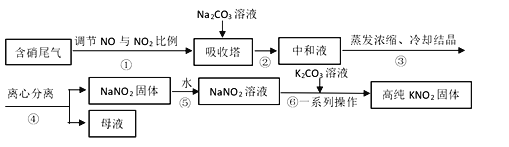
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
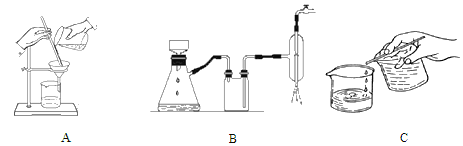
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2