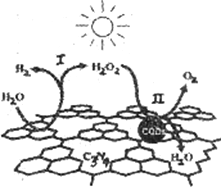
题目内容
【题目】(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。

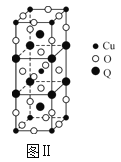
(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。

【答案】Ti4CN3 +3 C
【解析】
(1)利用均摊法计算该晶胞中含有的各种原子个数,从而确定其化学式;
(2)利用均摊法计算出晶胞中Q、Cu、O三种原子的个数,再利用化合物中化合价代数和为零可计算出Q的化合价;
(3)根据图示,分别判断A、B、C 的配位数,再结合Cr的配位数为6判断。
(1)该晶胞中碳原子个数=8×![]() ,N原子个数=6×
,N原子个数=6×![]() ,Ti原子个数=1+12×
,Ti原子个数=1+12×![]() ,所以其化学式为Ti4CN3,故答案为:Ti4CN3;
,所以其化学式为Ti4CN3,故答案为:Ti4CN3;
(2)根据均摊法结构晶胞结构图可知,晶胞结构中Cu原子数目为1+8×![]() =2,O原子数目为2+4×
=2,O原子数目为2+4×![]() +16×
+16×![]() =8,Q原子数目为2+8×
=8,Q原子数目为2+8×![]() =4,设Q的化合价为a,化合物中各元素总化合价为0,则:4a+2×2+8×(-2)=0,解得:a=3,即Q的化合价为+3,故答案为:+3;
=4,设Q的化合价为a,化合物中各元素总化合价为0,则:4a+2×2+8×(-2)=0,解得:a=3,即Q的化合价为+3,故答案为:+3;
(3)根据题意可知,图中A的配位数为12,B的配位数为2,C的配位数为6,Cr的配位数为6,说明图中C原子代表的是Cr原子,故答案为:C。

 阅读快车系列答案
阅读快车系列答案【题目】为提纯下列物质![]() 括号内为杂质
括号内为杂质![]() ,所用的除杂试剂和分离方法都正确的是( )
,所用的除杂试剂和分离方法都正确的是( )
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 溴乙烷(Br2) | NaOH溶液 | 蒸馏 |
C | 溴苯(液溴) | 乙醇 | 分液 |
D | 乙醇(水) | 新制生石灰 | 蒸馏 |
A.AB.BC.CD.D
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,回答下列问题:
(1)用分析天平准确称取该样品5.0g,全部溶于水配制成1000.0mL的溶液。用____(填一仪器名称)量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测。该中和滴定中可选用的指示剂是__________________________,(如有几种,可任填一种)滴定终点的现象是___________________________________________________________。
(2)用0.10mol/L的盐酸溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中,NaOH的质量百分含量为__________________。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果______(填“偏高”、“偏低”或“不变”,下同),若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果_______;
(4)下图为0.10mol/L 25 mL NaOH溶液中逐滴滴加0.10mol/L CH3COOH溶液过程中溶液pH的变化曲线,请回答:

①B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?______(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间。(若正确,此问不答)。
②在D点时,溶液中c(CH3COO-)+c(CH3COOH)______2c(Na+)。(填“>”、“<”或“=”)