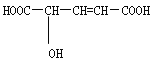题目内容
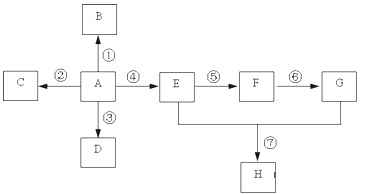
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
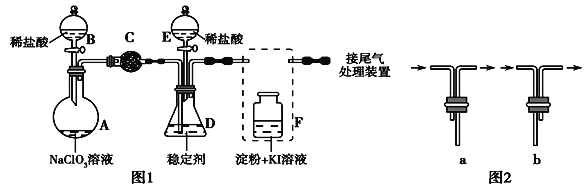
(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,
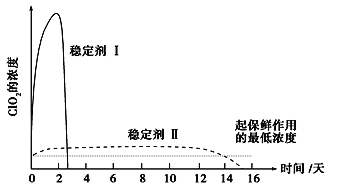
理由:_____________________________________________________________。
【答案】 圆底烧瓶 b 慢 吸收Cl2 4H++5ClO![]() ===Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度
===Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度
【解析】试题分析:(1)仪器D的名称为锥形瓶;让气体和淀粉-KI溶液反应,应是长管进气短管出气,故选项b 正确;(2)要让气体充分气体全部吸收,通入ClO2速率要慢,即滴加稀盐酸的速度宜慢;(3)NaClO3和稀盐酸反应,ClO3-转化成ClO2,Cl-被氧化成氯气,除生成ClO2外,还有Cl2的产生,ClO2和氯气的氧化性相近,因此必须除去氯气,防止干扰,因此装置C的作用是吸收Cl2;(4)根据题目中信息以及化合价升降法配平,其离子反应方程式为:4H+ + 5ClO2- ="C" l- + 4ClO2↑ +2 H2O;ClO2和Cl2的性质相似,能把I-氧化成I2,淀粉变蓝,因此装置F的作用是验证是否有ClO2生成;(5)根据图像,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,故稳定剂II正确。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。