题目内容
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
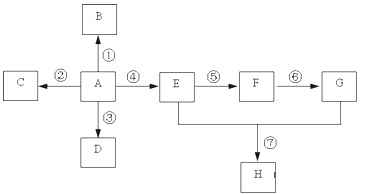
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:反应① ___________,反应②___________。
【答案】(12)(1)碳碳双键;羟基
(2)![]() ;CH2=CH2+H2O
;CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O
CH3CH2OOCCH3+H2O
(3)加聚反应;氧化反应
【解析】
试题分析:已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。设A的分子式为CxHy,则x=![]() ,则A的相对分子质量M(A)=
,则A的相对分子质量M(A)=![]() ,y=
,y=![]() 。所以A的分子式为C2H4,A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键。
。所以A的分子式为C2H4,A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键。
根据转化关系可知,乙烯发生加聚反应生成高分子化合物B,则B为聚乙烯;C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2气体,反应②为乙烯的燃烧反应,也是氧化反应;D为烃,不能使酸性高锰酸钾溶液褪色,则D为乙烯与氢气发生加成反应生成物乙烷;E、G为生活中常见的有机物,且E有特殊香味,H有香味,则E为乙烯与H2O的发生加成反应的产物乙醇;乙醇催化氧化生成乙醛,F为乙醛;乙醛进一步催化氧化生成乙酸,G为乙酸;乙酸和乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯H。据此可得下列结论:
(1)A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键;E为乙醇,官能团为羟基。
故答案为:碳碳双键;羟基;
(2)反应①为乙烯的加聚反应,化学方程式为:![]() 。
。
故答案为:![]() ;
;
反应④为乙烯和水的加成反应,化学方程式为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
反应⑦为乙酸和乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯,化学方程式为:CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O。
CH3CH2OOCCH3+H2O。
故答案为:CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O;
CH3CH2OOCCH3+H2O;
(3)反应①的反应类型为加聚反应;反应②的反应类型为氧化反应。
故答案为:加聚反应;氧化反应。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
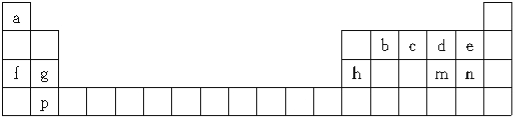
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。