题目内容
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
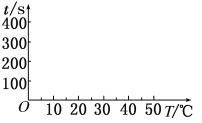
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。
【答案】(1)Zn + 2H+=Zn2+ + H2↑;放热 (2)50 ; 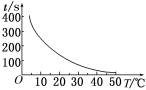 (2分)
(2分)
(3)温度每升高10℃,反应速率加快到原来的2倍
(4) >;G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快
> F组中锌为粉末状,表面积较大,反应速率较快
【解析】
试题分析:(1)Zn与盐酸反应生成氯化锌和氢气,离子反应为Zn + 2H+=Zn2+ + H2↑,反应放出热量,为放热反应;
(2)由A、B、C、D中的实验可知,温度每升高10℃时,时间减少一半,则t1=100s×1/2=50s,时间对温度的曲线图为 ;
;
(3)该反应中温度影响反应速率的规律是温度每升高10℃,反应速率加快到原来的2倍,故答案为:温度每升高10℃,反应速率加快到原来的2倍;
(4)G组中可形成Cu-Zn原电池,发生原电池反应,反应速率加快,则t1>t4;F组中锌为粉末状,表面积较大,反应速率较快,则t2>t3。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
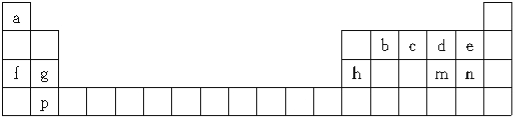
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
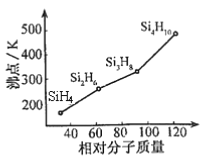
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。