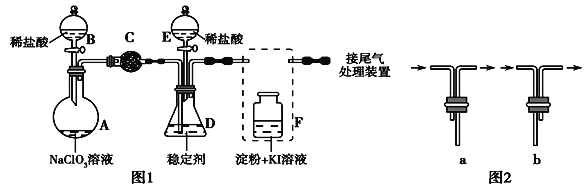
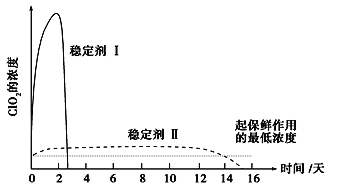
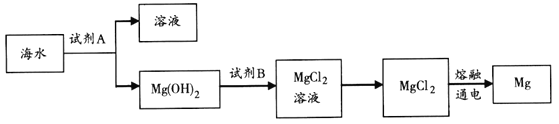
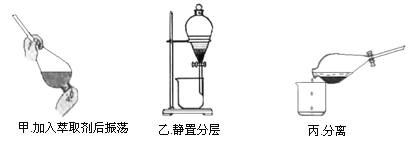
题目内容
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为_________________________。
(2) 已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是_______________,原子半径由大到小的顺序是 。
(3)A+、B—、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B—![]() C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
(4) ①NH4NO3②NaF ③CO2④K2O2⑤NaOH ⑥CH4
只含有极性键的是________,既有离子键又有非极性键的是______;既有离子键又有极性键的是______.
【答案】(1) HClO4,Cl2+2NaOH===NaClO+NaCl+H2O;
(2)Y>X>Z>W,X>Y>W>Z
(3)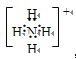 ,
,![]() ,H2O>NH3;
,H2O>NH3;
(4)③⑥,④,①⑤ 。
【解析】试题分析:(1)价电子数为7,说明属于第VIIA族,有三个电子层,说明位于第三周期,即Cl,最高价氧化物对应水化物的化学式为HClO4,Cl2和NaOH反应,发生歧化反应,其化学反应方程式为:Cl2+2NaOH=NaClO+NaCl+H2O;(2)核外电子排布相同,说明阳离子在阴离子的下一周期,根据同周期化合价的排布规律,原子序数为Y>X>Z>W,原子半径是电子层数越多,半径越大,同周期从左向右半径减小,原子半径大小顺序是X>Y>W>Z;(3)都是10e-微粒,在加热分条件下,发生信息中的反应,NH4++OH-![]() NH3↑+H2O,其电子式分别为:
NH3↑+H2O,其电子式分别为: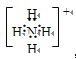 ,
,![]() ,同周期从左向右,非金属性增强,氢化物的稳定性增强,即H2O>NH3;(4)①既含有离子键和极性共价键;②只含有离子键;③只含有极性键;④含有离子键和非极性键;⑤含有离子键和极性共价键;⑥只含有极性键,③⑥,④,①⑤ 。
,同周期从左向右,非金属性增强,氢化物的稳定性增强,即H2O>NH3;(4)①既含有离子键和极性共价键;②只含有离子键;③只含有极性键;④含有离子键和非极性键;⑤含有离子键和极性共价键;⑥只含有极性键,③⑥,④,①⑤ 。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案