题目内容
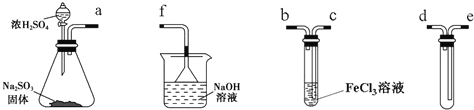
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH![]() CH2===CH2↑+H2O,回答下列问题:
CH2===CH2↑+H2O,回答下列问题:
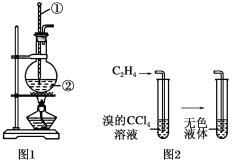
(1)图1中仪器①、②的名称分别为________、________。
(2)收集乙烯气体最好的方法是________。
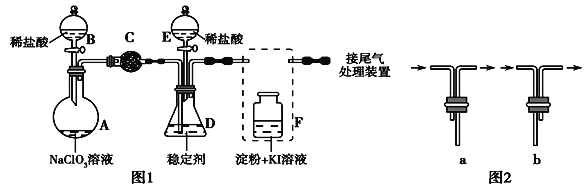
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于____(填反应类型),反应的化学方程式为_______。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
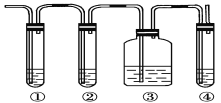
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①__________;②__________;③__________;④__________。
A.品红溶液 B.氢氧化钠溶液
C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________。
(3)使用装置②的目的是________________________________。
(4)使用装置③的目的是_______________________________。
(5)验证含有乙烯的现象是________________________________。
【答案】Ⅰ(1)温度计 、圆底烧瓶;(2)排水法;(3)加成反应;CH2=CH2+Br2→CH2BrCH2Br
Ⅱ(1)① A ; ② B; ③ A; ④ D (2)①中品红溶液褪色 (3) 吸收SO2 (4)检验SO2 是否被除尽 (5)③中品红溶液不褪色,④中KMnO4溶液褪色
【解析】
试题分析:Ⅰ.(1)图1中仪器①用于测量反应温度,名称为温度计;仪器②用于盛放乙醇和浓硫酸的混合液,名称为圆底烧瓶。
(2)乙烯的密度与空气密度接近,不能使用排空气法收集,乙烯不溶于水,可以用排水法收集乙烯。
(3)向溴的四氯化碳溶液中通入乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,所以溶液的颜色很快褪去,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br。
Ⅱ.(1)乙烯不与NaOH溶液反应,但二氧化硫能与碱反应,SO2+2NaOH=Na2SO3+H2O,二氧化硫是否存在可用品红溶液检验,乙烯的检验应放在排除SO2的干扰后进行,先通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色实验检验乙烯,所以答案为① A;② B;③ A;④ D。
(2)二氧化硫是否存在可用品红溶液检验,所以答案为装置①中品红溶液褪色。
(3)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,检验乙烯时应先除去二氧化硫,所以使用装置②的目的是吸收二氧化硫气体,以免干扰乙烯的实验。
(4)根据上述分析,使用装置③的目的是检验SO2 是否被除尽。
(5)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,所以验证含有乙烯的现象是③中品红溶液不褪色,④中KMnO4溶液褪色。