题目内容
【题目】I.乙烯是是由裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
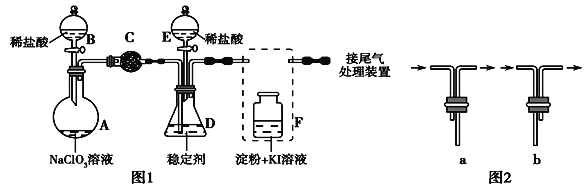
下图是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
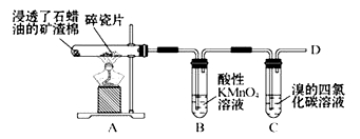
(1)A中碎瓷片的作用是 。
(2)B中反应类型是 。C中实验现象是 。
II.现有CH4、C2H4、C6H6三种有机化合物:
(3)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。生成二氧化碳最多的是__________,生成水最多的是_________。
III.(4)分子式为C9H12的苯的同系物有 种,若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为 。
(5)分子中含有22 个共价键的烷烃,烷烃的分子式: 。
(6)支链只有一个乙基且式量最小的烷烃的结构简式 ,其名称为 。
(7)将某种烷烃进行氯代反应,测出一氯代物有4 种。3.6g 该烃完全生成一氯代物时,放出的气体用蒸馏水完全吸收,所得溶液用0.1 mol·L-1NaOH 溶液500mL恰好中和。则此烷烃的分子式为 ,其结构简式为 。
【答案】
(1)催化作用;
(2)氧化反应;溴的四氯化碳溶液褪色;
(3)CH4;苯;CH4;
(4)8; ;
;
(5)C7H16;
(6)![]() ;3-乙基戊烷;
;3-乙基戊烷;
(7)C5H12;CH3CH2CH(CH3)2。
【解析】
试题分析:(1)由题意:石蜡油在炽热碎瓷片的作用下产生乙烯,可知其作用主要是催化剂,加快反应速率;故A中碎瓷片的作用是催化作用;(2)乙烯可以被KMnO4氧化,生成CO2,发生的是氧化反应;乙烯中含有一个碳碳双键,可以和溴发生加成反应,使溴的四氯化碳溶液褪色;(3)CH4中H元素质量分数大于C2H4、苯中H元素质量分数,故等质量的有机物完全燃烧,CH4耗氧量较大;等质量的以上三种物质完全燃烧时,碳的质量分数越大,则生成CO2的量越多,苯中碳的质量分数大,则生成CO2的量多;CH4中H元素质量分数大于C2H4、苯中H元素质量分数,故等质量的有机物完全燃烧,甲烷产生的水最多;(4)有机物C9H12的芳香烃的同分异构体,要考虑取代基异构和苯环上的位置异构,有![]() 、
、![]() 、
、 、
、 、
、![]() 、
、 、
、 、
、 8种不同的结构;若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为
8种不同的结构;若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为 ;(5)烷烃分子式通式是CnH2n+2,含有的化学键的数目是(n-1)+(2n+2)=3n+1。解得n=7,所以该烷烃的分子式是C7H16;(6)该烷烃相当于甲烷中的氢原子被烃基取代,如果有乙基,主链上碳原子最少有5个,所以该烃相当于甲烷中的3个氢原子被乙基取代,故该烃的结构简式
;(5)烷烃分子式通式是CnH2n+2,含有的化学键的数目是(n-1)+(2n+2)=3n+1。解得n=7,所以该烷烃的分子式是C7H16;(6)该烷烃相当于甲烷中的氢原子被烃基取代,如果有乙基,主链上碳原子最少有5个,所以该烃相当于甲烷中的3个氢原子被乙基取代,故该烃的结构简式![]() ;CH3CH2CHCH2CH3 CH2CH3(7)设一氯代烃为R-Cl,与氢氧化钠发生反应:R-Cl+NaOH
;CH3CH2CHCH2CH3 CH2CH3(7)设一氯代烃为R-Cl,与氢氧化钠发生反应:R-Cl+NaOH ![]() R-OH+NaCl,反应消耗NaOH的物质的量为n(NaOH)=0.5L×0.1mol/L=0.05mol,则一氯代烃的物质的量为0.05mol,故烃A的物质的量为0.05mol,则烃A的摩尔质量是M=3.6g÷0.05mol==72g/mol,根据烷烃的分子式通式CnH2n+2,则烃A的分子式为C5H12 ,可能结构简式有:CH3CH2CH2CH2CH3, CH3CH2CH(CH3)2;C(CH3)4,烷烃进行氯代反应,测出一氯代物有4 种,则该烃分子中有四种氢原子,故结构简式为CH3CH2CH(CH3)2。
R-OH+NaCl,反应消耗NaOH的物质的量为n(NaOH)=0.5L×0.1mol/L=0.05mol,则一氯代烃的物质的量为0.05mol,故烃A的物质的量为0.05mol,则烃A的摩尔质量是M=3.6g÷0.05mol==72g/mol,根据烷烃的分子式通式CnH2n+2,则烃A的分子式为C5H12 ,可能结构简式有:CH3CH2CH2CH2CH3, CH3CH2CH(CH3)2;C(CH3)4,烷烃进行氯代反应,测出一氯代物有4 种,则该烃分子中有四种氢原子,故结构简式为CH3CH2CH(CH3)2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。