题目内容
5.下列各组的电极材料和电解液不能组成原电池的是( )| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
分析 根据原电池的构成条件判断是否能构成原电池,原电池的构成条件是:1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;2、电极均插入电解质溶液中;3、两极相互连接(或接触);4、能自发的发生氧化还原反应.
解答 解:A.酒精为非电解质,溶液不导电,不能形成原电池,故A选;
B.两电极的活泼性不同,且铜片与硝酸银溶液能自发的发生氧化还原反应,所以能构成原电池,故B不选;
C.两金属的活泼性不同,且锌片与稀盐酸能自发的发生氧化还原反应,所以能构成原电池,故C不选;
D.两金属的活泼性不同,且铜片与氯化铁溶液能自发的发生氧化还原反应,所以能构成原电池,故D不选.
故选A.
点评 本题考查了原电池的设计,为高频考点,侧重于学生的分析能力以及双基的考查,难度不大,根据原电池的构成条件分析判断即可.

练习册系列答案
相关题目
15.下列关于铷的叙述中正确的是( )
| A. | 硝酸铷是离子化合物 | |
| B. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 它位于周期表的第四周期、第ⅠA族 |
13.有两种金属的合金10.5克,与足量稀硫酸反应后,产生的气体在标况下占体积11.2L,则组成该合金的元素可能是( )
| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
20.下列关于铷(Rb)的叙述正确的是( )
| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
6. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
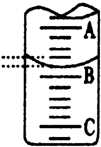
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.
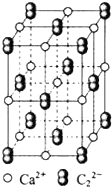 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.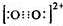 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.

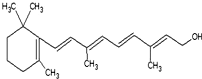 (1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.
(1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.