题目内容
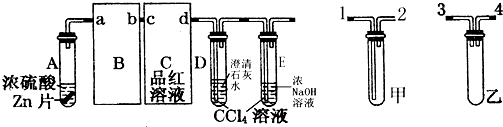
10.如图装置可用于实验室制备常见气体并验证气体的某些特定反应或性质.请你帮助化学探究小组利用有关装置完成下列实验.
Ⅰ.某探究小组利用图中装置A、B、C、G制取饱和氯水,B中盛放饱和食盐水,C中盛放蒸馏水.
(1)写出A装置中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)有同学认为在C中的长导管下口处接H装置,可以提高氯气的吸收效果.原因是增大了氯气与水的接触面积.
(3)G装置烧杯内溶液中得到三种钠盐,则反应的离子方程式为Cl2+H2O+2CO32-═Cl-+ClO-+2HCO3-.
Ⅱ.某探究小组利用图中装置A、D、E、F探究氯气的特定反应.
(4)若将D装置接入A和E之间,正确的接法是a→e(填“e”或“d”).
(5)实验开始时,先点燃A处酒精灯,让Cl2充满整个装置,再点燃E处酒精灯,连接F装置.Cl2通过D瓶后再进入E装置,E装置的硬质玻璃管内盛有碳粉,Cl2、水蒸气与碳粉发生氧化还原反应,生成两种气体,且体积比为1:4(气体体积在相同条件下测定).写出E中发生反应的化学方程式:2Cl2+2H2O(g)+C$\frac{\underline{\;△\;}}{\;}$4HCl+CO2,为了使D装置更好地发挥作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解.
(6)A、D、E、F装置中有一处需要改进,说明需要改进的理由:E中产生的气体中含有大量极易溶于水的HCl气体,易引起倒吸.
Ⅲ.某探究小组利用图中装置A、B、C、G探究SO2具有漂白性和还原性.则装置B中盛放品红溶液(填溶液名称),装置C中盛放酸性高锰酸钾溶液(填溶液名称),证明SO2具有漂白性的现象为B中品红溶液褪色.
分析 Ⅰ.(1)A是利用浓盐酸和二氧化锰加热制取氯气的装置;
(2)将导管换成多孔球泡,能够增大气体与溶液的接触面积;
(3)氯气与碳酸钠溶液反应能够得到三种盐,应为氯化钠、次氯酸钠和碳酸氢钠;
Ⅱ.(4)D装置的作用是带出水蒸气,导管应长进短出;
(5)据氧化还原反应中得失电子守恒和原子守恒书写化学方程式,D的作用是让氯气带出水蒸气,烧杯中加入浓硫酸,浓硫酸溶于水放热,促进试管里的水蒸发,且气体的溶解度随温度的升高而减小;
(6)反应生成HCl,HCl是极易溶于水的气体;
Ⅲ.探究SO2具有漂白性用品红溶液,探究SO2具有还原性用酸性高锰酸钾.
解答 解:Ⅰ.(1)浓盐酸和二氧化锰加热生成氯气、氯化锰和水,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)将导管换成多孔球泡,能够增大气体与溶液的接触面积,故答案为:增大了氯气与水的接触面积;
(3)氯气与碳酸钠溶液反应能够得到三种盐,应为氯化钠、次氯酸钠和碳酸氢钠,离子方程式为:Cl2+H2O+2CO32-═Cl-+ClO-+2HCO3-,
故答案为:Cl2+H2O+2CO32-═Cl-+ClO-+2HCO3-;
Ⅱ.(4)D装置的作用是带出水蒸气,导管应长进短出,故答案为:e;
(5)Cl2、水蒸气与碳粉发生氧化还原反应,生成两种气体,且体积比为1:4,则生成两种气体为HCl和CO2,反应方程式为2Cl2+2H2O(g)+C$\frac{\underline{\;△\;}}{\;}$4HCl+CO2,为使D中更快地产生水蒸气,在烧杯中加入浓硫酸,稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解,
故答案为:2Cl2+2H2O(g)+C$\frac{\underline{\;△\;}}{\;}$4HCl+CO2;稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解;
(6)反应生成大量HCl气体,其极易溶于水发生倒吸,所以需要改进,故答案为:E中产生的气体中含有大量极易溶于水的HCl气体,易引起倒吸;
Ⅲ.探究SO2具有漂白性用品红溶液,探究SO2具有还原性用酸性高锰酸钾,所以B中盛放品红溶液,C中盛放酸性高锰酸钾,证明SO2具有漂白性的现象为B中品红溶液褪色,故答案为:品红溶液;酸性高锰酸钾溶液;B中品红溶液褪色.
点评 本题通过氯气的制取和性质探究考查了氧化还原反应方程式书写、尾气处理等知识点,是高考必考知识点,注意常见气体的制取和性质实验.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 干冰、铁、氯化氢 | B. | 生石灰、白磷、纯碱 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、胆矾(CuSO4•5H2O) |
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |

(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是Fe3+、Al3+.
(2)对溶液进行操作时,控制溶液pH=9~10(有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致Al(OH)3溶解,Ca(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
②若将二氧化碳气体通人澄清石灰水中,石灰 水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示CaCO3(s)?Ca2+(aq)+CO32-(aq).
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |