题目内容
16. 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是sp2、sp;分子中处于同一直线上的原子数目最多为3.
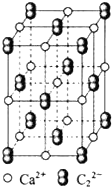
(3)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长.CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.
分析 (1)等电子体结构和性质相似,C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式;一个O22+中含有2个π键;
(2)根据价层电子对互斥理论判断C原子杂化类型;H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上;
(3)根据图知,以最中心钙离子为例,判断钙离子配位数.
解答 解:(1)等电子体结构和性质相似,C22-与O22+和氮气互为等电子体,根据氮气分子电子式书写O22+电子式为 ;一个O22+中含有2个π键,1mol O22+中含有的π键数目为2NA,
;一个O22+中含有2个π键,1mol O22+中含有的π键数目为2NA,
故答案为: ;2NA;
;2NA;
(2)H2C=CH-C≡N分子中连接双键的C原子价层电子对个数是3且不含孤电子对,所以为sp2杂化,连接三键的碳原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
H2C=CH-C≡N中连接三键两端原子的原子位于同一直线上,位于碳碳双键两端碳原子的原子位于同一平面上,所以该分子中位于同一直线上的原子为3个,
故答案为:sp、sp2;3;
(3)根据图知,以最中心钙离子为例,CaC2晶体中1个Ca2+周围距离最近的C22-数目为4,故答案为:4.
点评 本题考查晶胞计算、原子杂化、等电子体等知识点,这些都是高频考点,明确价层电子对互斥理论、等电子体特点即可解答,难点是(3)题配位数个数判断,注意该晶胞中是长方体而不是正方体,为易错点.

练习册系列答案
相关题目
7.下列化学反应属于吸热反应的是( )
| A. | Ba(OH)2•8H2O+2NH4Cl=BaCl2•6H2O+2NH3•2H2O+2H2O | |
| B. | Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ | |
| D. | 8Al+3Fe3O4=4Al2O3+9Fe |
4.下列有关物质的性质、反应现象的描述及其原理解释均正确,且符合因果关系的是( )
| 选项 | 物质的性质或反应现象 | 原理解释 |
| A | SO2通入溴水,溴水褪色 | SO2有漂白性 |
| B | 碱性:NaOH>Al(OH)3 | 金属性:Na>Al |
| C | 白磷比N2的性质活泼 | 非金属性:P>N |
| D | 少量Na投入CuSO4溶液中,Na可以置换出Cu | 活泼性:Na>Cu |
| A. | A | B. | B | C. | C | D. | D |
11.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
8.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
5.下列各组的电极材料和电解液不能组成原电池的是( )
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
 ;
; 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.

