题目内容
20.下列关于铷(Rb)的叙述正确的是( )| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
分析 A.Rb和K位于同一主族,且在K元素下一周期;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比;
D.活泼金属和酸根离子之间易形成离子键.
解答 解:A.Rb和K位于同一主族,且在K元素下一周期,所以Rb位于第五周期第IA族,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Rb>K,KOH是强碱,所以Rb也是强碱,故B错误;
C.金属晶体中,金属键越强其熔沸点越高,金属键与原子半径成反比,金属键Na>K>Rb,所以单质的熔沸点中钠最高,故C错误;
D.Rb是活泼金属,易和硝酸根离子之间形成离子键,所以硝酸铷是离子化合物,故D正确;
故选AD.
点评 本题以铷为载体考查碱金属元素,侧重考查同一主族元素性质递变规律及知识迁移能力,以钠、钾为例采用知识迁移的方法解答即可,题目难度不大.

练习册系列答案
相关题目
10.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
11.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24 L CHCl3的碳原子总数为0.1 NA | |
| B. | 1 mol甲醇中含有C-H键的数目为4NA | |
| C. | 1 mol-OH中电子数为10 NA | |
| D. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
8.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
15.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图:
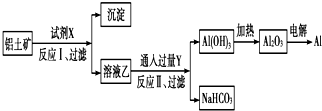
对上述流程中的判断不正确的是( )

对上述流程中的判断不正确的是( )
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |
5.下列各组的电极材料和电解液不能组成原电池的是( )
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
1. 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
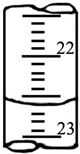
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)①,若测定结果偏高,其原因可能是ABCD.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红,且半分钟内不变色.
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60 mLmL.
(4)根据下列数据:请计算待测盐酸溶液的浓度:0.2000mol/L.
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
19.用98%的浓硫酸(其密度为1.84g/cm3)配制成100mL 1.0mol/L稀硫酸时,实验时遇到下列情况,将会使所配的溶液浓度偏高的是( )
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题: