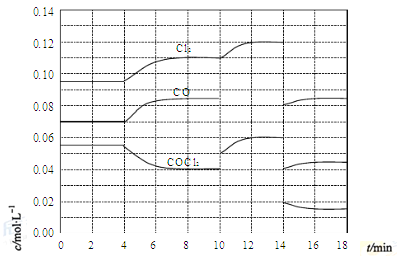
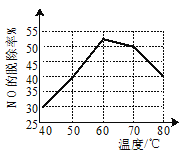
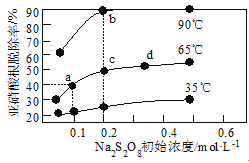
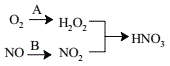题目内容
【题目】室温下,某二元碱![]() 水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是( )
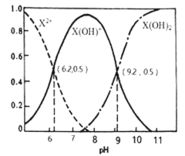
A.![]() 的数量级为
的数量级为![]()
B.![]() 水溶液显碱性
水溶液显碱性
C.等物质的量的![]() 和
和![]() 混合溶液中
混合溶液中![]()
D.在![]() 水溶液中,
水溶液中,![]()
【答案】C
【解析】
A.根据图像分析, Kb2=![]() , Kb2的数量级为10-8,故正确;
, Kb2的数量级为10-8,故正确;
B.X(OH)NO3水溶液中,X主要以X(OH)+形式存在,由图示可知,此时溶液中,pH位于7-8之间,因此水溶液呈弱碱性,故正确;
C.X2+的水解常数为由Kb2计算得10-6.2,等物质的量的X(NO3)2和X(OH)NO3混合溶液中,c(X2+)< c(X(OH)+),故错误;
D.在X(OH)NO3水溶液中,存在电荷守恒,c(NO3-)+c(OH-)=2c(X2+)+c(H+)+c(X(OH)+),存在物料守恒c(NO3-)= c(X2+)+c(X(OH)+)+ c(X(OH)2),将物料守恒的关系式代入电荷守恒可得c(X(OH)2) +c(OH-)= c(X2+)+ c(H+),故正确。
故选C。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
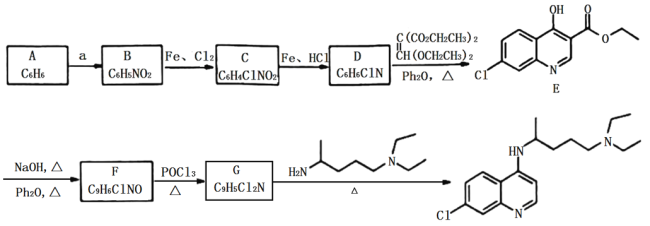
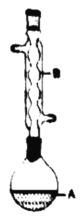
应用题作业本系列答案【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
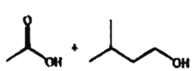
![]()
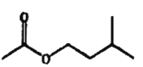 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。