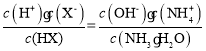题目内容
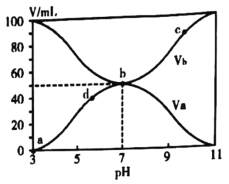
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2,下列有关说法正确的是( )

A.a、b、c三点中,水的电离程度最大的为b点
B.如不考虑CuS的溶解,则c点溶液有:2[c(S2-)+c(HS-)+c(H2S)]═c(Cl-)
C.该温度下Ksp(CuS)=2×10-18mol2/L2
D.该温度下,反应:![]() 的平衡常数为
的平衡常数为![]()
【答案】B
【解析】
A.CuCl2、Na2S水解促进水电离,b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离没有影响,水的电离程度最小的为b点,故A错误;
B. c点时,溶液中的n(Cl-)为0.002 mol,Na2S过量0.001 mol,由物料守恒可得2[c(S2-)+c(HS-)+c(H2S)]═c(Cl-),故B正确;
C. b点是CuCl2与Na2S溶液恰好完全反应的点,溶液中c(Cu2+)=c(S2-),根据b点数据可知c(Cu2+)=1×10-17.7 mol/L,则该温度下Ksp(CuS)=c(Cu2+)c(S2-)=1×10-35.4 mol2/L2=4×10-36mol2/L2,故C错误;
D. ZnS(s)+Cu2+(aq) ![]() CuS(s)+Zn2+(aq)平衡常数为
CuS(s)+Zn2+(aq)平衡常数为![]() =
=![]() =
=![]() =7.5×1010,故D错误;
=7.5×1010,故D错误;
故选B。

【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%