题目内容
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
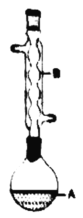

![]()
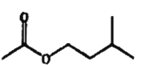 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。
【答案】圆底烧瓶 洗掉反应剩余的大部分硫酸和醋酸 洗掉碳酸氢钠 d 提高异戊醇的转化率或者是提高乙酸异戊酯的产率 做吸水剂和催化剂 冷却后再补加沸石,重新加热蒸馏 60% 高 会收集少量未反应的异戊醇和乙酸。
【解析】
圆底烧瓶中发生异戊醇和乙酸在浓硫酸作催化剂的条件下发生酯化反应,加入2~3片碎瓷片防止爆沸,经水洗除去大部分催化剂硫酸和醋酸,用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,加入少量无水![]() 固体可以去除产物中的水,利用酯的沸点收集到140~143℃馏分,得乙酸异戊酯,根据乙酸和异戊醇的物质的量关系,计算出乙酸异戊酯的理论产量,用实际产量除以理论产量可得产率。
固体可以去除产物中的水,利用酯的沸点收集到140~143℃馏分,得乙酸异戊酯,根据乙酸和异戊醇的物质的量关系,计算出乙酸异戊酯的理论产量,用实际产量除以理论产量可得产率。
(1)没有具支试管的烧瓶称为圆底烧瓶,装置A是圆底烧瓶;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高异戊醇的转化率;
(5) 乙酸和异戊醇生成乙酸异戊酯的实验中,产物中有水,浓硫酸是吸水剂和催化剂;
(6)在蒸馏操作中,忘记加入沸石应冷却后再补加沸石,重新加热蒸馏;
(7)乙酸的物质的量为:![]() ,异戊醇的物质的量为:
,异戊醇的物质的量为:![]() ,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成
,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成![]() 乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量
乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量![]() ,所以实验中乙酸异戊酯的产率为:
,所以实验中乙酸异戊酯的产率为: ![]() ;
;
(8)在进行蒸馏操作时,若从110℃便开始收集馏分此时的蒸气中含有异戊醇和乙酸,会收集少量的未反应的异戊醇和乙酸,因此会导致产率偏高。

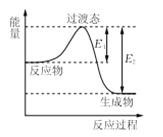
【题目】化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | 172 | 335 | 498 | X |
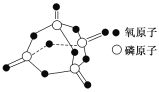
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的.”这个规律被称为盖斯定律.有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:
C(石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ/mol②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599.2 kJ/mol③
则由C(石墨)和H2(g)反应生成1 mol C2H2(g)的焓变为__________________。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量。已知单质碳的燃烧热为y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为______________。
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是 ___________________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____________。理由是_____________。
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |