题目内容
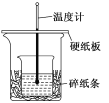
【题目】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升____________?
【答案】若剩余的气体是NO,则NO2和O2的体积分别为9.2 mL和0.8 mL;若剩余的气体是O2,则NO2和O2的体积分别为6.4 mL和3.6 mL
【解析】
根据2NO2+H2O=2HNO3+NO和4NO2+O2+2H2O=4HNO3并结合剩余气体的成分进行计算。
剩余2 mL气体可能是NO或O2,分两种情况讨论:
(1)剩余的是NO,可以看成先发生了反应:4NO2+O2+2H2O===4HNO3剩余的NO2又与水作用,最终有2 mL NO 产生。由反应3NO2+H2O===2HNO3+NO得,剩余的NO2体积为2 mL×3=6 mL。则原有O2体积为(10 mL-6 mL)×![]() =0.8 mL,NO2体积为10 mL-0.8 mL=9.2mL;
=0.8 mL,NO2体积为10 mL-0.8 mL=9.2mL;
(2)剩余的是O2,则有10 mL-2 mL=8 mL NO2和O2的混合气体按反应4NO2+O2+2H2O=4HNO3进行。所以NO2的体积为8 mL×![]() =6.4 mL,O2体积为10 mL-6.4 mL=3.6mL。
=6.4 mL,O2体积为10 mL-6.4 mL=3.6mL。

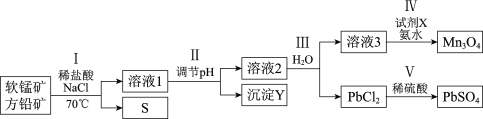
【题目】下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置.用化学符号回答下列各问题.
周期 |
|
|
|
|
|
|
| 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)10种元素中,化学性质最不活泼的是_________.
(2)①、③、⑤三种元素最高价氧化物对应水化物中,碱性最强的是_________.
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_________.
(4)元素⑦的简单氢化物的化学式为_____;若该氢化物和元素⑨的单质反应,则化学方程式为_______.
(5)⑤和⑨的最高价氧化物对应水化物的化学式分别为_________和_________.
(6)①和⑤最高价氧化物对应水化物相互反应的离子方程式为__________________.