题目内容
10. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
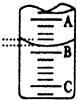
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL.
(3)在滴定的过程中,时左手轻轻挤压碱式滴定管的玻璃球,右手边滴边振荡锥形瓶,眼睛应观察锥形瓶内溶液颜色变化,至锥形瓶由无色变为浅红色且半分钟内不复原(滴定终点判断),停止滴定,记录滴定管的计数.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸物质的量浓度的表达式不必化简):$\frac{25.30×c}{V}$.
分析 (1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂; 量取酸应该用酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度为25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(3)通过观察溶液颜色变化判断终点,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,变浅红色;
(4)根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$判断不当操作对相关物理量的影响;
(5)利用平均值计算醋酸的质量,再根据酸度公式计算其酸度.
解答 解:(1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;
白醋是酸,应该用酸式滴定管量取,故答案为:酚酞,酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,
故答案为:25.40;
(3)通过观察溶液颜色变化判断终点,所以滴定时眼睛要观察锥形瓶内溶液颜色变化;滴定时锥形瓶中为酸性溶液,酚酞在酸性溶液中为无色,达到终点溶液稍显碱性,变浅红色,则锥形瓶由无色变为浅红色且半分钟内不复原,说明达到滴定终点;
故答案为:锥形瓶内溶液颜色变化;锥形瓶由无色变为浅红色且半分钟内不复原;
(4)从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,上面测得的醋酸浓度偏大,
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,导致氢氧化钠体积偏小,所以所测醋酸浓度偏小,故错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,导致氢氧化钠体积偏大,所以所测醋酸浓度偏大,故正确;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,导致氢氧化钠浓度偏小,所以所用氢氧化钠体积偏大,所测醋酸浓度偏大,故正确;
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,润洗锥形瓶导致醋酸的物质的量偏大,所以使用的氢氧化钠体积偏大,所测醋酸浓度判断,故正确;
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,导致使用的氢氧化钠体积偏小,所测醋酸浓度偏小,故错误;
故答案为:BCD;
(5)第一次误差较大舍去,醋酸和氢氧化钠反应的物质的量相等,两次使用氢氧化钠的平均体积=$\frac{25.32+25.28}{2}$=25.30mL,
醋酸的物质的量等于氢氧化钠的物质的量,
所以c(醋酸)=$\frac{n}{V}$=$\frac{25.30×c}{V}$mol/L;
故答案为:$\frac{25.30×c}{V}$.
点评 本题考查酸碱滴定实验,难度中等,会根据实际需要选取指示剂,注意滴定管上的刻度和量筒上刻度的区别,为易错点,明确实验原理、步骤以及误差分析的方法即可解答.

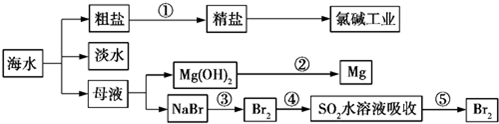
| A. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
 实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下
实验室用乙酸和正丁醇制备乙酸正丁酯的反应如下CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
物质的相关数据如下表:
| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在干燥的50ml圆底烧瓶中,加入3.7g的正丁醇和3.3g冰醋酸,再加入2~3滴浓硫酸,摇匀,投入1~2粒沸石 按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口.打开冷凝水,圆底烧瓶在石棉网上用小火加热.在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.反应达到终点后,停止加热,记录分出的水的体积.
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用适量的水洗涤.有机层继续用一定体积10%Na2CO3洗涤至中性,再用适量的水洗涤,最后将有机层转移至锥形瓶中,再加入少量无水硫酸镁固体.静置片刻,过滤除去硫酸镁固体.
③将②处理后的乙酸正丁酯滤入50 mL 烧瓶中,进行蒸馏纯化,收集126.1℃的馏分,得乙酸正丁酯3.5g.
回答有关问题:
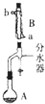
(1)装置B的名称是球形冷凝管
(2)步骤①中判断反应终点的依据是分水器中的水层不再增加时,视为反应的终点
(3)产品的精制过程步骤②中,第一次水洗的目的是洗去大部分的硫酸和醋酸等用饱和Na2CO3溶液洗涤有机层,该操作的目的是除去产品中含有的残留酸等杂质第二次洗的目的是洗去乙酸正丁酯中的盐分实验中加入少量无水硫酸镁的目的是干燥
(4)下列关于蒸馏操作的说法,正确的是B
A、温度计的水银柱应插入到液面以下
B、蒸馏过程中,加入沸石(碎瓷片)的目的是防止暴沸
C、冷凝管进出水的方向是上进下出
D、为提高蒸馏的速度,可以不用石棉网而直接用酒精灯进行加热.
(5)步骤③的常压蒸馏,需收126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂
(6)该实验过程中,列式计算生成乙酸正丁酯的产率(保留2位有效数字)60%.
| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |

 ;
;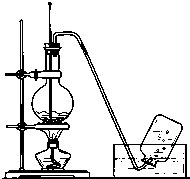 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时: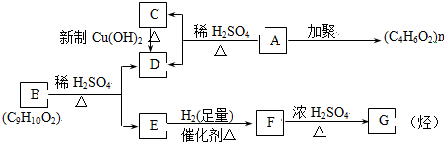
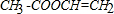 ,B:
,B: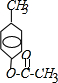 ;
;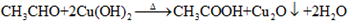 ,
,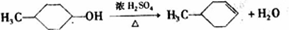 .
.