题目内容
5.2.4g C与4.8g O2混合,一定条件下,完全反应后所得产物是CO、CO2,其物质的量是0.1mol、0.1mol.分析 :C与氧气反应会得到CO、CO2,C的物质的量为$\frac{2.4g}{12g/mol}$=0.2mol,氧气物质的量为$\frac{4.8g}{32g/mol}$=0.15mol,故C、O原子数目之比为0.2mol:0.15mol×2=2:3,由于1:2<2:3<1:1,故反应生成CO、CO2,由碳原子、氧原子守恒列方程计算各自物质的量.
解答 解:C与氧气反应会得到CO、CO2,C的物质的量为$\frac{2.4g}{12g/mol}$=0.2mol,氧气物质的量为$\frac{4.8g}{32g/mol}$=0.15mol,故C、O原子数目之比为0.2mol:0.15mol×2=2:3,由于1:2<2:3<1:1,故反应生成CO、CO2,
设CO、CO2的物质的量分别为xmol、ymol,由碳原子、氧原子守恒,则:
$\left\{\begin{array}{l}{x+y=0.2}\\{x+2y=0.15×2}\end{array}\right.$
解得x=y=0.1
故答案为:CO、CO2;0.1mol、0.1mol.
点评 本题考查化学方程式有关计算,关键是判断反应产物,侧重考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
16.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Na+、Ba2+、AlO2-、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、K+、NO3-、SiO32- |
13.类比推理的方法是化学学习与研究中有广泛的应用,但有时会得出错误的结论,以下几种类比推理结论中正确的是( )
| A. | H2SO4为强酸,推出HClO4为强酸 | |
| B. | Fe3Cl8可以改写为FeCl2 •2FeCl3,推出Fe3I8可以改写为FeI2 •2FeI3 | |
| C. | NH3的沸点高于PH3,推出CH4沸点高于SiH4 | |
| D. | CO2 通入Ba(NO3)2 溶液中无沉淀生成,推出SO2通入Ba(NO3)2 溶液中无沉淀生成 |
20.一定条件下,在容积为1L密闭容器发生可逆反应:A(g)+2B(g)?2C(g),实验测得当生成2mol C时,放出了QkJ的热量.若条件不变起始向容器中充入1mol C,则反应达平衡时的热效应为( )
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
10.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀,该有机样品可能是( )
| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
7.下列实验过程中,溶液的pH减小的是( )
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
4.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):
请帮助该同学整理并完成实验报告.
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
(4)实验结论:同周期元素随原子序数增大,元素金属性逐渐减弱,非金属性逐渐增强.
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动随之消失,溶液变成红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生气体可以在空气中燃烧 |
| ④镁带与2mol•L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2mol•L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠 | F.生成淡黄色沉淀 |
(1)实验目的:验证Na、Mg、Al、S、Cl元素从左到右金属性依次减弱、非金属性依次增强的规律.
(2)实验用品:试管、酒精灯、砂纸、镊子、小刀、胶头滴管.
(3)实验内容:
| 实验方案 (填序号) | 实验现象 (填序号) | 有关化学方程式 |
(5)请用物质结构理论简单说明具有上述结论的原因同周期元素,随原子序数增大,原子核对核外电子的吸引能力逐渐增强,原子失去电子的能力逐渐减弱,得电子能力逐渐增强.
5.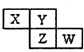 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | Z的离子半径小于Y的离子半径 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |