题目内容
10.某有机样品3.1g完全燃烧,燃烧后的混合物通入过量的澄清石灰水,石灰水共增重7.1g,经过滤得到10g沉淀,该有机样品可能是( )| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
分析 石灰水共增重7.1g,为燃烧生成的二氧化碳与水的质量,10g沉淀为碳酸钙的质量;有机物中的碳全部转化为二氧化碳,有机物中的氢全部转化为水,计算二氧化碳、水的物质的量,进而计算C元素、H元素的质量,根据质量守恒判断有机物中是否含有氧元素,根据原子守恒计算有机物的最简式,结合选项判断.
解答 解:l0g沉淀为CaCO3,物质的量为:$\frac{10g}{100g/mol}$=0.1mol,根据碳元素守恒可知,产生的二氧化碳为0.1mol,二氧化碳的质量为0.1mol×44g/mol=4.4g,其中碳元素质量为:0.1mol×12g/mol=1.2g,
石灰水增重7.1g,所以有机物燃烧生成的水的质量为:7.1-4.4=2.7g,物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol;氢元素质量为0.3mol×1g/mol=0.3g,
有机样品共3.1g,所以O元素物质的质量=3.1g-1.2g-0.3g=1.6g,氧原子物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol.
即3.1g有机物中n(C)=0.1mol,n(H)=0.15mol×2=0.3mol,n(O)=0.1mol,碳、氢、氧原子的物质的量之比为0.1mol:0.3mol:0.1mol=1:3:1,即最简式为CH3O,
选项中只有甲醇和丙三醇按1:1混合时其平均分子式为C2H6O2,符合条件,
故选D.
点评 本题考查有机物分子式的确定,题目难度中等,根据质量守恒确定有机物的是否含有氧元素是关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.下列叙述正确的是( )
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
12.一定条件下,在体积一定的密闭容器中加入1mol N2和3mol H2发生反应:N2 (g)+3H2 (g)$?_{催化剂}^{高温高压}$2NH3 (g)△H=-92kJ/mol.下列有关说法正确的是( )
| A. | 降低温度可以使平衡正向移动,可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 向容器中再加入N2,可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
10.下列有关硬水及其软化的说法中错误的是( )
| A. | 离子交换法可以软化硬水 | |
| B. | 生产、生活使用的天然水必须经软化 | |
| C. | 硬水中含有较多Ca2+、Mg2+ | |
| D. | 加热可使暂时硬水中的Ca2+生成CaCO3沉淀 |

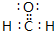 ,推测该分子的空间构型为平面三角形.
,推测该分子的空间构型为平面三角形. 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系: