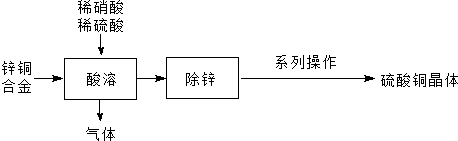
题目内容
15.下列说法正确的是( )| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
分析 A.ⅡA族、He及某些过渡元素的最外层电子数为2;
B.主族元素X、Y能形成XY2型化合物,化合物可能为CO2、MgCl2;
C.分子类型相同,相对分子质量大的沸点高;
D.Li、Na、K随原子序数逐渐增大,金属键减弱,熔点依次降低.
解答 解:A.原子最外层电子数为2的元素,不一定处于周期表ⅡA族,如He,故A错误;
B.主族元素X、Y能形成XY2型化合物,化合物可能为CO2、MgCl2,则X与Y的原子序数之差可能为2或5,故B正确;
C.分子晶体的相对分子质量越大,沸点越高,则氯化氢的沸点比溴化氢的沸点低,故C错误;
D.碱金属元素的单质,原子序数越大,原子半径越大,金属键越弱,熔沸点越低,则单质熔点:Li>Na>K,故D错误;
故选B.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.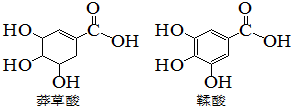 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
3.将0.390g锌粉加入到20.0mL 0.200mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A. | M | B. | M2+ | C. | M3+ | D. | MO2+ |
20.下列叙述正确的是( )
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
7.化学与生产生活、环境保护、资源利用密切相关.下列做法不正确的是( )
| A. | 用工业废水直接灌溉农田 | B. | 用可降解塑料做购物袋 | ||
| C. | 将煤气化或液化获得清洁燃料 | D. | 火力发电厂的燃煤中加适量石灰石 |
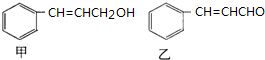
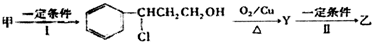
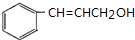 +HCl$\stackrel{一定条件下}{→}$
+HCl$\stackrel{一定条件下}{→}$ ,反应II的反应类型为消去反应.
,反应II的反应类型为消去反应.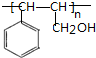 .
.