题目内容
5.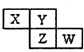 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | Z的离子半径小于Y的离子半径 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
分析 短周期元素,由图可知X、Y在第二周期,Y原子的最外层电子是内层电子数的3倍,则Y为氧元素,依次推出X为氮元素,Z为硫元素,W为氯元素,然后利用非金属性的强弱来分析解答.
解答 解:短周期元素,由图可知X、Y在第二周期,Y原子的最外层电子是内层电子数的3倍,即K层电子为2,L层为6,其质子数为8,则Y为氧元素,由元素在周期表中的位置可知X为氮元素,Z为硫元素,W为氯元素,
A、电子层数越多,离子半径越大,所以S2-的半径大于O2-,故A错误;
B、同周期从左到右元素的非金属性增强,则非金属性W>Z,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C、同主族元素从上到下非金属性减弱,则非金属性Y>Z,故C错误;
D、X与Y形成的化合物NO不溶于水,故D错误;
故选:B.
点评 本题考查位置、结构、性质的应用,明确短周期及元素在周期表中的位置来推断即可,Y是学生解答本题的突破口.

练习册系列答案
相关题目
16.下列除去括号内杂质的有关操作中正确的是( )
| A. | 苯(苯酚) 加浓溴水,振荡,分液 | |
| B. | 福尔马林(甲酸) 加纯碱溶液,分液 | |
| C. | 乙醇(乙酸) 加NaOH溶液,过滤 | |
| D. | 乙酸乙酯(乙酸) 加饱和Na2CO3溶液,分液 |
13.下列属于物理变化的是( )
| A. | 煤的干馏 | B. | 钢铁生锈 | C. | 干冰升华 | D. | 食物腐败 |
20.下列实验装罝、操作或现象描述正确的是( )
| A. | 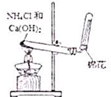 实验室制取NH3 | B. | 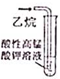 溶液颜色褪去 | C. | 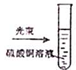 看到光亮的通路 | D. | 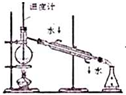 石油蒸馏 |
10.下列有关硬水及其软化的说法中错误的是( )
| A. | 离子交换法可以软化硬水 | |
| B. | 生产、生活使用的天然水必须经软化 | |
| C. | 硬水中含有较多Ca2+、Mg2+ | |
| D. | 加热可使暂时硬水中的Ca2+生成CaCO3沉淀 |
17.常温下,向pH=2的醋酸溶液中加入少量0.01mol•L-1的盐酸,溶液中一定发生变化的是( )
| A. | c(CH3COO-) | B. | KW | C. | Ka(CH3COOH) | D. | c(H+) |
14.为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液、水 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 除去CH4中的C2H4 | ]试管、带导管的橡皮塞 | 酸性KMnO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
15.已知外电路中,电子由铜流向a极.有关图所示的装置分析合理一项是( )
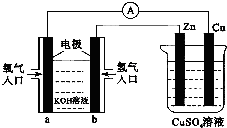

| A. | 该装置中Cu极为正极 | |
| B. | 当铜极的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L | |
| C. | b极反应的电极反应式为:H2-2e-═2H+ | |
| D. | 一段时间后锌片质量减少 |