题目内容
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
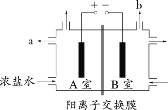
(1)试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______,B接______。
(2)碳棒上发生的电极反应为_______。
(3)能说明氯气具有氧化性的实验现象是_______。
(4)假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为____。
(5)工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是__(填“阳离子”或“阴离子”)交换膜,溶液A是_______(填溶质的化学式)
【答案】G、F、I D、E、C 2Cl--2e-=Cl2↑ 淀粉-KI溶液变成蓝色 12 阳离子 NaOH
【解析】
(1)实验的目的是电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性,结合装置的作用来连接装置;
(2)实验目的生成氢气和氯气,所以铁应为阴极,碳棒为阳极;
(3)氯气具有氧化性,能氧化碘离子生成碘单质,使淀粉碘化钾溶液变蓝色说明;
(4)电解饱和食盐水的方程式:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,利用公式c=
2NaOH+H2↑+Cl2↑,利用公式c=![]() 来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;
来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH;
(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过;a极上氯离子失电子,生成氯气同时溶液中生成NaOH。
(1)产生的氢气的体积用排水量气法,预计H2的体积6ml左右,所以选I不选H,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C;
(2)实验目的生成氢气和氯气,所以铁应为阴极,连接电源负极,碳棒为阳极,所以炭棒接直流电源的正极,电极反应:2Cl--2e-═Cl2↑;
(3)氯气具有氧化性,能氧化碘离子生成碘单质,碘单质遇到淀粉变蓝色,使淀粉碘化钾溶液变蓝色说明氯气具有氧化性;
(4)因电解饱和食盐水的方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,当产生的H2的体积为5.6mL时,物质的量n=
2NaOH+H2↑+Cl2↑,当产生的H2的体积为5.6mL时,物质的量n=![]() =2.5×10-4mol,生成氢氧化钠的物质的量为5×10-4mol,所以溶液中NaOH的物质的量浓度=
=2.5×10-4mol,生成氢氧化钠的物质的量为5×10-4mol,所以溶液中NaOH的物质的量浓度=![]() ═0.01mol/L,所以氢离子的浓度=
═0.01mol/L,所以氢离子的浓度=![]() mol/L=1×10-12mol/L,pH=12;
mol/L=1×10-12mol/L,pH=12;
(5)氢气在阴极生成,则b为阴极,a为阳极,阳离子向阴极移动,则离子交换膜允许阳离子通过,所以离子交换膜为阳离子交换膜;a极上氯离子失电子,生成氯气同时溶液中生成NaOH,所以溶液A是NaOH。

 名校课堂系列答案
名校课堂系列答案【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
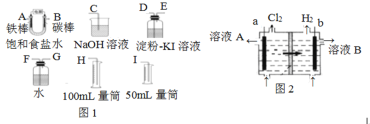
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
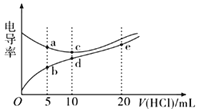
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
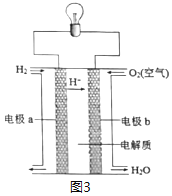
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O