题目内容
【题目】氢气是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)为探究实验室制取氢气的合适条件,探究学习小组用如图所示装置制取氢气。

①仪器b的名称是___,若用锌粒和3molL-1H2SO4制取氢气可选用上述仪器中的___(填字母序号)组成氢气的制备和收集装置。
②实验测得H2的生成速率如图2所示:
根据t1~t2时间速率变化判断该反应是___反应(填“吸热”或“放热”)。t2~t3时间速率变化的主要原因是___。
③若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是___。
(2)已知:化学键的键能是指气态原子间形成1mol化学键时释放的能量。几种化学键的键能如下表所示:
键能(kJmol-1) | |
H-H | 436 |
S=S | 255 |
H-S | 339 |
1molS2(g)与足量H2完全反应生成H2S,放出___kJ的热量。
(3)以H2为原料设计成氢氧燃料电池,电池的构造如图3所示,下列说法正确的是___(在原电池中发生氧化反应的电极称为负极)。
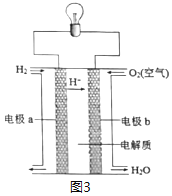
A.电极b是该电池的正极 B.该电池的能量转化率可达100%
C.可用蔗糖溶液作电解质溶液 D.供电时的总反应为:2H2+O2=2H2O
【答案】长颈漏斗 bde 放热 随着反应进行硫酸浓度降低 接触面积增大,加快反应速率 229 AD
【解析】
(1)①根据装置图判断仪器b的名称;用锌粒和3molL-1H2SO4制取氢气属于固液不加热制取气体;
②根据影响反应速率的因素回答;
③用锌粉代替锌粒进行实验,增大反应物的接触面积;
(2)根据焓变=反应物的总键能-生成物的总键能计算;
(3)根据原电池原理回答;
![]() 根据装置,仪器b的名称是长颈漏斗;用锌粒和3
根据装置,仪器b的名称是长颈漏斗;用锌粒和3![]()
![]() 制取氢气属于固液不加热制取气,所以可选用上述仪器中的分液漏斗、锥形瓶和氢气收集装置,选bde;
制取氢气属于固液不加热制取气,所以可选用上述仪器中的分液漏斗、锥形瓶和氢气收集装置,选bde;
![]()
![]() 时间段内反应速率加快,说明体系温度升高,所以根据
时间段内反应速率加快,说明体系温度升高,所以根据![]() 时间速率变化判断该反应是放热反应;
时间速率变化判断该反应是放热反应;![]() 时间段内反应速率减慢,所以
时间段内反应速率减慢,所以![]() 时间速率变化的主要原因是随着反应进行硫酸浓度降低;
时间速率变化的主要原因是随着反应进行硫酸浓度降低;
![]() 若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是:接触面积增大,加快反应速率;
若用锌粉代替锌粒进行实验,氢气的生成速率明显加快的原因是:接触面积增大,加快反应速率;
![]()
![]() 与足量
与足量![]() 完全反应生成
完全反应生成![]() ,化学方程式:
,化学方程式:![]() ,反应焓变
,反应焓变![]() ,1mol
,1mol![]() 与足量
与足量![]() 完全反应生成
完全反应生成![]() ,放出229KJ的热量;
,放出229KJ的热量;
![]() 通入氧气的一极发生还原反应,b为原电池的正极,电极反应式为
通入氧气的一极发生还原反应,b为原电池的正极,电极反应式为![]() ,故A正确;
,故A正确;
B.能量转化有化学能转化为电能、热能,该电池的能量转化率不可能可达![]() ,故B错误;
,故B错误;
C.蔗糖为非电解质不能导电,不能用作原电池的电解质溶液,故C错误;
D.供电时是氢气和氧气发生反应生成水的过程,反应的化学方程式为:![]() ,故D正确。
,故D正确。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为_______________________________。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是_______________________________(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈_______________________________(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)_______________________________。
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
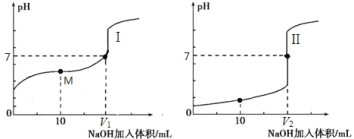
①滴定醋酸的曲线是_______________________________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是_______________________________。
③ V1 和 V2 的关系:V1_______________________________V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________________________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 | 出现白色沉淀。 |
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 | 溶液变红色。 |
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 | 现象 a ,溶液红色变浅。 |
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 | 白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式_____。
② 步骤 3 中现象 a 是_____。
③ 用化学平衡原理解释步骤 4 的实验现象_____。
(4)某小组模拟工业上回收分银渣中的银,过程如下:
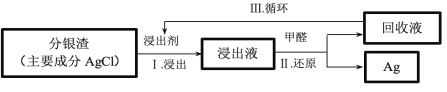
过程 I 的主要反应:AgCl+2![]()
![]()
![]() +Cl-
+Cl-
过程 II 的离子反应:4![]() +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8![]() +4H2O+
+4H2O+![]()
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:_____。