题目内容
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)

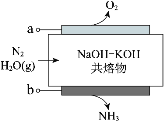
(1)把NaCl和AlCl3的固体混合物置于下图所示的装置的一端,加热到_______(最低温度)℃,即可分离NaCl和AlCl3
![]()
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有_______;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是_______
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:
①H++OH![]() H2O,
H2O,
②________
(4)镀铝电镀池中,金属铝为____极,熔融盐电镀池中存在Na+K+AlCl4-Al2Cl7-等离子钢材表面(电极)的电极反应式为AlCl4-+3e-![]() Al+4Cl-或_________
Al+4Cl-或_________
(5)钢材镀铝后,在表面氧化成致密的_____________,避免钢材接触空气而防止钢材被腐蚀
【答案】181 HCl、AlCl3 NaCl Cl2 + 2OH-== Cl- + ClO- + H2O 阳 Al2Cl7-+6e-=2Al +7Cl- 氧化铝膜
【解析】
(1)AlCl3在181℃升华,故加热到181℃,即可分离NaCl和AlCl3
(2)粗铝熔体里含有Na和H2,通Cl2后会生成NaCl和HCl,另外温度过高AlCl3易升华,因此气泡里还有HCl及AlCl3,固体浮渣中应该有NaCl。
(3)气体A的成份为HCl和Cl2,用NaOH吸收时发生反应的离子方程式是:
② Cl2 + 2OH-== Cl- + ClO- + H2O
(4)镀铝电镀池中,镀层金属作阳极,金属铝为阳极;待镀的钢材为阴极,表面(电极)的电极反应式:
Al2Cl7-+6e-="=2Al" +7Cl-
(5)铝能防腐就是表面能氧化生成致密的A12O3膜的缘故。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案