题目内容
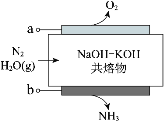
【题目】下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
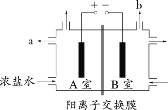
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
【答案】D
【解析】
A.Ca(OH)2有一定溶解度,用NaOH并不能将少量的钙离子除去,故A错误;
B.B室与电源负极相连为阴极,电极反应为2H2O+2e-=H2↑+2OH-,所以转移0.2mol电子时生成0.1mol氢气,标况下体积为2.24L,故B错误;
C.A室为阳极,浓盐水中的氯离子放电得到氯气,钠离子经阳离子交换膜进入阴极,所以a处得到的是稀的NaCl溶液,故C错误;
D.氯气可以和氢氧根反应,适当降低阳极电解液的 pH 有利于Cl2逸出,故D正确;
故答案为D。

【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为_______________________________。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是_______________________________(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈_______________________________(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)_______________________________。
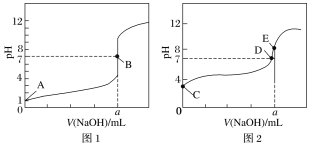
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
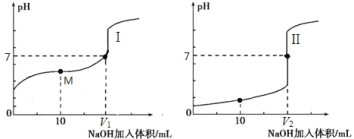
①滴定醋酸的曲线是_______________________________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是_______________________________。
③ V1 和 V2 的关系:V1_______________________________V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________________________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 | 出现白色沉淀。 |
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 | 溶液变红色。 |
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 | 现象 a ,溶液红色变浅。 |
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 | 白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式_____。
② 步骤 3 中现象 a 是_____。
③ 用化学平衡原理解释步骤 4 的实验现象_____。
(4)某小组模拟工业上回收分银渣中的银,过程如下:
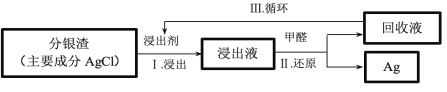
过程 I 的主要反应:AgCl+2![]()
![]()
![]() +Cl-
+Cl-
过程 II 的离子反应:4![]() +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8![]() +4H2O+
+4H2O+![]()
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:_____。