��Ŀ����
����Ŀ���״���CH3OH����һ����ɫ�д̼�����ζ��Һ�壬������������Ҫ��;��ͬʱҲ��һ����Ҫ�Ļ���ԭ�ϡ�
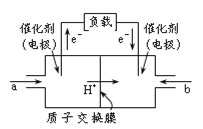
��1���״�ȼ�ϵ����Ŀǰ������ɹ���ȼ�ϵ��֮һ������ȼ�ϵ���ɼ״���������KOH��Һ���������Һ�����ɣ�������˵����ȷ����___��
����֪�״��ڿ�����ȼ������CO2��H2O��
A.��طŵ�ʱͨ������ĵ缫Ϊ����
B.��طŵ�ʱ�����ĵ缫��ӦʽΪCH3OH-6e-=CO2��+2H2O
C.��طŵ�ʱ���������Һ�ļ�������
D.��طŵ�ʱÿ����6.4gCH3OHת��1.2mol����
��2��д���״�ȼ�ϵ�������������¸����ĵ缫��Ӧʽ��___��
���𰸡�CD CH3OH+H2O-6e-=CO2��+6H+
��������
(1) A. ͨ�״��ĵ缫Ϊ������ͨ�����ĵ缫Ϊ������A�����
B. �ڼ��Ե������Һ�и����ĵ缫��ӦʽΪ![]() ��B�����
��B�����
C. �ڷŵ�����У�OH-����缫��Ӧ�����ϱ����ģ����µ������Һ���Լ�����C����ȷ��
D. ��طŵ�ʱÿ����6.4gCH3OH����0.2molCH3OH��ת�Ƶ�����![]() ��D����ȷ���ʴ�ѡCD��
��D����ȷ���ʴ�ѡCD��
(2)�״�ȼ�ϵ���У������������¼״��ڸ���ʧ��������CO2���缫��ӦʽΪCH3OH+H2O-6e-=CO2��+6H+���ʴ�Ϊ��CH3OH+H2O-6e-=CO2��+6H+��