题目内容
【题目】(1)已知1mol石墨转化为1mol金刚石要吸收能量,则1mol石墨的能量比1mol金刚石的能量___(填“高”或“低”),石墨比金刚石___(填“稳定”或“不稳定”)。
(2)Ba(OH)28H2O和NH4Cl反应的化学方程式是___,该反应是 ___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合___(填“图1”或“图2”)。

(3)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___。

【答案】低 稳定 Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 吸热 图2 Mg与盐酸反应放出热量,烧杯中饱和澄清石灰水的温度升高,Ca(OH)2的溶解度降低,从溶液中析出
【解析】
(1)吸收能量,则反应物能量低,能量越低,物质稳定;
(2)Ba(OH)28H2O和NH4Cl发生复分解反应,该反应吸收热量;
(3)饱和澄清石灰水的温度升高,Ca(OH)2的溶解度降低。
(1) 1mol石墨转化为1mol金刚石要吸收能量,则1mol石墨的能量比1mol金刚石的能量低,能量越低,物质稳定,石墨比金刚石稳定,故答案为:低;稳定;
(2)Ba(OH)28H2O和NH4Cl发生复分解反应,生成![]() 、
、![]() 和
和![]() ,方程式为:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,该反应吸收热量,故生成物总能量比反应物总能量高,图2符合,故答案为:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;吸热;图2;
,方程式为:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,该反应吸收热量,故生成物总能量比反应物总能量高,图2符合,故答案为:Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;吸热;图2;
(3)Mg与盐酸反应放出热量,导致石灰水温度升高,而Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2固体,从而使溶液浑浊,故答案为:Mg与盐酸反应放出热量,烧杯中饱和澄清石灰水的温度升高,Ca(OH)2的溶解度降低,从溶液中析出。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为_______________________________。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是_______________________________(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)Ⅰ.两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠。实验室现有醋酸钠固体,取少量溶于水,溶液呈_______________________________(选填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示)_______________________________。
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
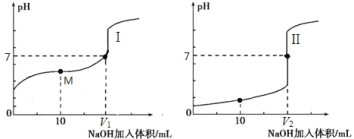
①滴定醋酸的曲线是_______________________________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是_______________________________。
③ V1 和 V2 的关系:V1_______________________________V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________________________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。 资料:AgSCN 是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 | 出现白色沉淀。 |
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 | 溶液变红色。 |
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 | 现象 a ,溶液红色变浅。 |
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 | 白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式_____。
② 步骤 3 中现象 a 是_____。
③ 用化学平衡原理解释步骤 4 的实验现象_____。
(4)某小组模拟工业上回收分银渣中的银,过程如下:
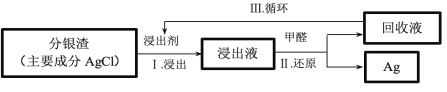
过程 I 的主要反应:AgCl+2![]()
![]()
![]() +Cl-
+Cl-
过程 II 的离子反应:4![]() +6OH- +HCHO=4Ag++8
+6OH- +HCHO=4Ag++8![]() +4H2O+
+4H2O+![]()
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:_____。
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ