��Ŀ����
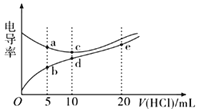
����Ŀ���������Һ��������Խǿ���絼��Խ��������0.1000 mol/L����ֱ�ζ�10.00 mLŨ�Ⱦ�Ϊ0.1000 mol/L��NaOH��Һ�Ͷ��װ�[(CH3)2NH]��Һ(���װ���ˮ�е����백���ƣ���֪�ڳ�����Kb[(CH3)2NH��H2O]=1.6��10-4)�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵����ȷ����( )
A.����ζ����װ�ʵ����ѡ���̪��ָʾ����ѡ��������С
B.d����Һ�У�c(H+)<c(OH-)+c[(CH3)2NH2+]
C.a����Һ��d�����Һ��Ϻ����Һ�У�c[(CH3)2NH2+]<c[(CH3)2NH��H2O]
D.b��c��e�������Һ�У�ˮ�ĵ���̶�������e��
���𰸡�B
��������
(CH3)2NHH2OΪ������ʣ�����Һ�в��ֵ��룬��Ũ��ʱ����Ũ�ȱ�NaOHС�����Խ������ɴ˿�֪��������Ϊ(CH3)2NHH2O�ı仯���ߣ�����ΪNaOH�ı仯���ߣ�����HCl��(CH3)2NHH2O��Һ������Ũ����������������ǿ��NaOH�����ᷢ���кͷ�Ӧ����ˮ������Ũ�ȼ�С����ͼ���֪����HCl 10 mLʱ��ȫ��Ӧ���Դ˽����⡣
A.����ζ����װ������ɵ�������װ�Ϊǿ�������Σ��ζ��յ���ҺӦ�����ԣ�Ӧ�ü���Ϊָʾ����A����
B��d��ǡ�÷�Ӧ����������װ���ˮ��������ԣ�����ˮ��̶Ƚ�С����c(H+)< c[(CH3)2NH2+]����c(H+)<c(OH-)+c[(CH3)2NH2+]������d����Һ�У����������غ㣬����c(H+)=c(OH-)+c[(CH3)2NH��H2O]������ˮ��̶Ƚ�С����c[(CH3)2NH2+]> c[(CH3)2NH��H2O]����c(H+)<c(OH-)+c[(CH3)2NH2+]��B��ȷ��
C��a����Һ�У�����Ϊ������NaCl��NaOH��d����Һ�У�����ΪCH3)2NH2Cl����a����Һ��d�����Һ��Ϻ�c[(CH3)2NH2+]=c[(CH3)2NH��H2O]����Һ����(CH3)2NH��H2O�ĵ����Լ�(CH3)2NH2+��ˮ�⣬��Kb[(CH3)2NH��H2O]=1.6��10-4��CH3)2NH2+��ˮ��ƽ�ⳣ��Kh=![]() =6.25��10-11<1.6��10-4����֪����̶ȴ���ˮ��̶ȣ����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C����
=6.25��10-11<1.6��10-4����֪����̶ȴ���ˮ��̶ȣ����c[(CH3)2NH2+]>c[(CH3)2NH��H2O]��C����
D��b����Һ������Ϊ(CH3)2NH2Cl��(CH3)2NH��H2O��(CH3)2NH��H2O�����OH-����ˮ�ĵ��룬c������ΪNaCl��ˮ�ĵ�����Ӱ�죬e�����Һ������Ϊ(CH3)2NH2Cl��HCl��HCl����ˮ�ĵ��룬����c��ˮ�ĵ���̶����D����
�ʺ���ѡ����B��