题目内容
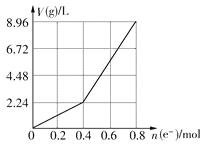
【题目】用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )
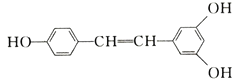
A.电解前CuSO4溶液的物质的量浓度为2 mol/L
B.电解后所得溶液中c(H+)=2 mol/L
C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3
D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
【答案】C
【解析】
A、从图上可看出,电解分为两个阶段;第一阶段电解CuSO4溶液,第二阶段电解水。当n(e-)=0.4 mol时,Cu2+消耗完,因而Cu2+的物质的量为0.2 mol,电解前其浓度为1 mol/L,A错误;
B、随着电解的进行,2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,生成的n(H+)为0.4mol,但溶液的体积会发生变化,因此c(H+)不是2 mol/L,B项错误;
2Cu+O2↑+2H2SO4,生成的n(H+)为0.4mol,但溶液的体积会发生变化,因此c(H+)不是2 mol/L,B项错误;
C、当n(e-)=0.6 mol时,得到O2 0.15 mol,而H2只在第二阶段产生,该阶段电子转移0.2 mol,得到H2 0.1 mol,C正确;
D、转移的电子n(e-)=0.4 mol之前,为电解CuSO4溶液,方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,加入0.2molCuO,即16g,可复原;转移电子的物质的量0.4mol~0.8mol,为电解水,2H2O
2Cu+O2↑+2H2SO4,加入0.2molCuO,即16g,可复原;转移电子的物质的量0.4mol~0.8mol,为电解水,2H2O![]() 2H2↑+O2↑,转移0.4mol电子,生成0.2molH2和0.1molO2,加入0.2molH2O,即3.6g,可复原;应加入16gCuO和3.6gH2O,D项错误;
2H2↑+O2↑,转移0.4mol电子,生成0.2molH2和0.1molO2,加入0.2molH2O,即3.6g,可复原;应加入16gCuO和3.6gH2O,D项错误;
答案选C。

【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为![]()
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ