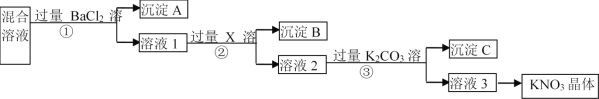
题目内容
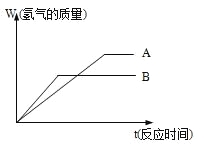
【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
【答案】B A B A 不足量 1 62g/mol
【解析】
(1)从图可知,B与盐酸的曲线的斜率要大,这个斜率就是反应的速率大小,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多(看最后平台对应的纵坐标),所以A的摩尔质量要小;
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了;
②计算最终生成氢气的物质的量,根据H原子守恒计算n(HCl),进而计算c(HCl);甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,则金属的平均摩尔质量═![]() 。
。
(1)从图可知,B与盐酸的速率比A大,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多,所以A的摩尔质量要小,所以两种金属氯化物的摩尔质量是B>A;
(2)①甲组实验,随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,乙组中的盐酸已经不足;
②最终生成氢气的物质的量为![]() =0.25mol,根据H原子守恒n(HCl)=0.25×2=0.5mol,所以c(HCl)=
=0.25mol,根据H原子守恒n(HCl)=0.25×2=0.5mol,所以c(HCl)= ![]() =1mol/L;甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为
=1mol/L;甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为![]() =0.1mol,故金属的平均摩尔质量═
=0.1mol,故金属的平均摩尔质量═![]() =62g/mol。
=62g/mol。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
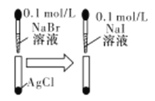
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D