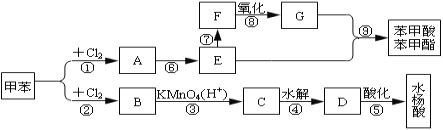
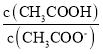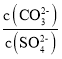题目内容
【题目】现有KNO3样品(含有少量杂质KCl、K2SO4),选择适当的试剂除去杂质,从而得到纯净的KNO3晶体,相应的实验流程如图所示。
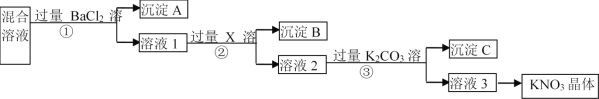
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__,沉淀C__、__。
(2)上述实验流程中①②③步均要进行的实验操作是__(填操作名称)。
(3)生成沉淀A的离子方程式是__。
(4)此实验方案存在缺陷,还应__,之后若要获得纯净的KNO3晶体,需进行的实验操作是__、__(填操作名称)。
【答案】AgNO3 BaCO3 Ag2CO3 过滤 Ba2++SO42-=BaSO4↓ 向溶液3中加入适量的稀HNO3 蒸发浓缩 冷却结晶
【解析】
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为![]() ,溶液1中含氯化钾、硝酸钾、氯化钡,②中加
,溶液1中含氯化钾、硝酸钾、氯化钡,②中加![]() 后氯离子转化沉淀,沉淀B为
后氯离子转化沉淀,沉淀B为![]() ,溶液2中含硝酸钾、硝酸银、硝酸钡,③中钡离子、银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钾和碳酸钾,转化中试剂过量保证离子完全转化为沉淀,
,溶液2中含硝酸钾、硝酸银、硝酸钡,③中钡离子、银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钾和碳酸钾,转化中试剂过量保证离子完全转化为沉淀,
(1)由上述分析可知,X为![]() ,沉淀C为碳酸钡、碳酸银,
,沉淀C为碳酸钡、碳酸银,
故答案为:![]() ;
;![]() ;
;![]() ;
;
(2)流程中①②③步均生成沉淀,需要进行过滤操作,
故答案为:过滤;
(3)①中加氯化钡,硫酸根离子转化为![]() 沉淀,离子方程式为:
沉淀,离子方程式为:![]() ,
,
故答案为:![]() ;
;
(4)溶液3中肯定含有![]() ,可加适量的稀硝酸后蒸发浓缩、冷却结晶得到纯净的硝酸钾,
,可加适量的稀硝酸后蒸发浓缩、冷却结晶得到纯净的硝酸钾,
故答案为:向溶液3中加入适量的稀![]() ; 蒸发浓缩;冷却结晶;
; 蒸发浓缩;冷却结晶;

【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
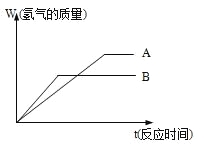
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。