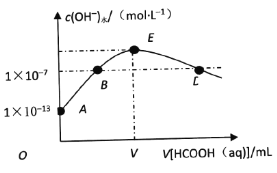
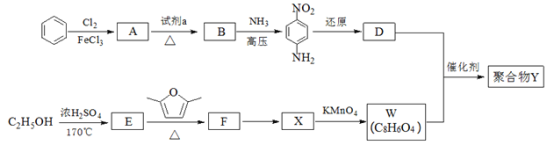
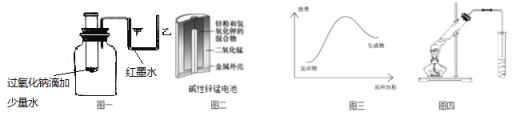
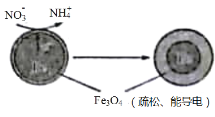
题目内容
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
【答案】D
【解析】
A.实验1中铝作的原电池的正极、2中铝作电池的负极,电极不相同,A回答正确;
B.实验2、3,铝作电池的负极,电解质溶液显酸性,电极反应式均为Al-3e-=Al3+,B回答正确;
C.实验4中铝电极作电池的负极,电解质溶液显碱性,生成偏铝酸根离子,电极反应式为Al-3e-+4OH-=![]() +2H2O,C回答正确;
+2H2O,C回答正确;
D.实验5中铝遇到浓硝酸钝化作原电池的负极,锌可与浓硝酸反应,铝钝化后,锌作原电池的负极,D回答错误;
综上所述,答案为D。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】资料显示自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快