题目内容
【题目】利用活性铁可以很好地消除酸性水体中NO3-造成的污染,除去原理如图所示。下列说法中正确的是
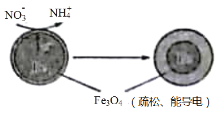
A.铁电极的电极反应式:3Fe-8e-+4H2O=Fe3O4+8H+
B.NO3-在负极上发生还原反应
C.除NO3-的过程中水体pH减小
D.当电路中有4 mol电子转移时,溶液中会有1 mol NH4+生成
【答案】A
【解析】
A. 在原电池反应中活泼金属作负极,铁作负极,氧化产物是Fe3O4,A正确;
B. NO3-应该在正极上得到电子,被还原产生NH4+,B错误;
C. 正极上NO3-得到电子,发生还原反应,正极的电极反应式为NO3-+8e-+10H+= NH4++3H2O,总反应方程式为:3Fe+H2O+NO3-+2H+= NH4++Fe3O4,可见:反应后水体中c(H+)减小,溶液的pH增大,C错误;
D. 根据选项C可知:每产生1 mol NH4+,转移8 mol电子,当转移4 mol电子时,生成的NH4+的物质的量为0.5 mol,D错误;
故合理选项是A。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。