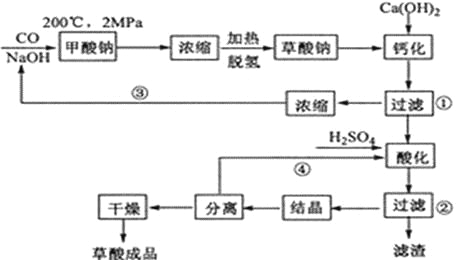
题目内容
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
【答案】b>a>c ②>①>③ ③>②>① ac CN-+H2S=HS-+HCN
【解析】
(1)体积相同、c(H+)相同的三种酸溶液,电离常数越小,起始浓度越大,而中和碱的能力,需使用酸的起始浓度。
(2)25℃时,等浓度的三种溶液,对应酸的酸性越弱,水解能力越强,溶液的pH越大。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,从水解方程式和水的电离方程式两方面分析阴离子总浓度关系。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,溶质为等浓度的HCN和NaCN,混合溶液中c(Na+)>c(CN-),则根据电荷守恒,c(H+)<c(OH-)。
a.由以上分析可知,c(H+)<c(OH-),a正确;
b.溶液中,溶质为等浓度的HCN和NaCN,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+ c(CN-),物料守恒:c(HCN)+c(CN-)=2c(Na+),则c(HCN)- c(CN-)=2[c(OH-)- c(H+)],b错误;
c.反应后的溶液中,根据物料守恒,c(HCN)+c(CN-)=0.01mol/L,c正确。
(5)25℃时,向NaCN溶液中通入少量H2S,因为氢硫酸的Ka2小于氢氰酸的Ka,则HS-与CN-不能发生反应,由此可得出反应的离子方程式。
(1)体积相同、c(H+)相同的三种酸溶液,电离常数越小,起始浓度越大,而中和碱的能力,酸的起始浓度越大,消耗碱的体积越大。醋酸的Ka=1.8×10-5,氢硫酸的Ka1=9.1×10-8,氢氰酸的Ka=4.9×10-10,则消耗NaOH溶液的体积由大到小的排列顺序是b>a>c。答案为:b>a>c;
(2)25℃时,等浓度的三种溶液,对应酸的酸性越弱,水解能力越强,溶液的pH越大。三种酸的酸性:醋酸>氢硫酸>氢氰酸,pH由大到小的顺序为②>①>③。答案为:②>①>③;
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,从水解方程式和水的电离方程式两方面分析阴离子总浓度关系。CN-+H2O![]() HCN+OH-,CH3COO-+H2O
HCN+OH-,CH3COO-+H2O![]() CH3COOH+OH-,Cl-不发生水解,此时三份溶液中的阴离子总浓度相等。在三份溶液中,H2O
CH3COOH+OH-,Cl-不发生水解,此时三份溶液中的阴离子总浓度相等。在三份溶液中,H2O![]() H++OH-,水解后的溶液中,c(OH-)越大,水的电离程度越小,最终溶液中阴离子的总浓度越小,故阴离子总浓度由大到小的顺序为③>②>①。答案为:③>②>①;
H++OH-,水解后的溶液中,c(OH-)越大,水的电离程度越小,最终溶液中阴离子的总浓度越小,故阴离子总浓度由大到小的顺序为③>②>①。答案为:③>②>①;
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,溶质为等浓度的HCN和NaCN,混合溶液中c(Na+)>c(CN-),则根据电荷守恒,c(H+)<c(OH-)。
a.由以上分析可知,c(H+)<c(OH-),a正确;
b.溶液中,溶质为等浓度的HCN和NaCN,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+ c(CN-),物料守恒:c(HCN)+c(CN-)=2c(Na+),则c(HCN)- c(CN-)=2[c(OH-)- c(H+)],b错误;
c.反应后的溶液中,根据物料守恒,c(HCN)+c(CN-)=0.01mol/L,c正确。
答案为:ac;
(5)25℃时,向NaCN溶液中通入少量H2S,因为氢硫酸的Ka2小于氢氰酸的Ka,则HS-与CN-不能发生反应,由此可得出反应的离子方程式为CN-+H2S=HS-+HCN。答案为:CN-+H2S=HS-+HCN。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡时,反应放出的热量为32.8kJB.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时H2O的转化率约为75%