题目内容
【题目】【化学——选修3:物质结构与性质】
铬、锰、铁、钴、镍等过渡金属元索的单质及其化合物在工农业、国防、科技等领域具存广泛应用。
(1)基态Cr原子中有_________个未成对电子,最外层电子所占用能级的电子云形状为_______。
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关,一般地,为d0或d10排布时,无颜色;为d1d9排布时,有颜色。则:[Mn(H2O)6]2+ ________(填“无”或“有”)颜色。
(3)不同温度下,铁单质晶胞的两种堆积方式如图所示
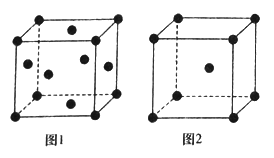
①图1和图2中Fe原子的配位数分别为_______________和________________。
②若图2的晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞中两个最近的Fe原子之间的距离为__________pm。(用含ρ、NA的代数式表示)
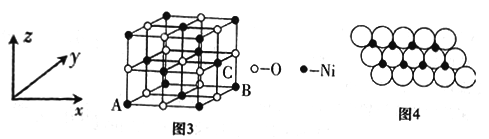
(4)已知MgO与NiO的晶体结构(如图3)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO__________NiO(填“>”“<”或“=”),理由是_______________。若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图4),已知O2-的半径为ɑ m,每平方米面积上分散的该晶体的质量为_________g。(用含ɑ、NA的代数式表示)
【答案】 6 球形 有 12 8 ![]() ×
×![]() ×1010(其他合理答案也给分) > Mg2-半径比Ni2-小,MgO的晶格能比NiO大 (1,
×1010(其他合理答案也给分) > Mg2-半径比Ni2-小,MgO的晶格能比NiO大 (1, ![]() ,
, ![]() )
) ![]() 或
或![]()
【解析】(1)Cr在元素周期表中是第四周期、第ⅥB族,原子序数是24,即其原子核外电子数是24,根据核外电子的排布规律可以写出该原子的电子排布式为:1s22s22p63s23p63d54s1或[Ar]3d54s1,其3d和4s轨道都是半充满的稳定结构,故有6个未成对电子;最外层电子所占用能级的电子云形状为球形;(2)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色;(3)①图1中Fe原子在顶点和面心,则配位数为4×3=12,图2中Fe原子在顶点和体心,则配位数为8;②晶胞中,铁原子的个数为8×![]() +1=2,设晶胞边长为acm,则体对角线为4r, 则体积为(
+1=2,设晶胞边长为acm,则体对角线为4r, 则体积为(![]() )3,则ρ=
)3,则ρ=![]() ,(
,(![]() )3=
)3=![]() ,r=
,r=![]() ×
×![]() ×1010pm;(4)Ni0、Mg0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径大于Mg2+的离子半径,所以熔点是MgO>NiO;若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则由图可看出C离子坐标离x为1,离y为
×1010pm;(4)Ni0、Mg0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径大于Mg2+的离子半径,所以熔点是MgO>NiO;若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则由图可看出C离子坐标离x为1,离y为![]() ,离z为
,离z为![]() ,则坐标参数为(1,
,则坐标参数为(1, ![]() ,
, ![]() );(6)根据结构知,氧离子和相邻的镍离子之间的距离为
);(6)根据结构知,氧离子和相邻的镍离子之间的距离为![]() a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的![]() 倍,所以其距离是2
倍,所以其距离是2![]() am;
am;
根据图片知,每个氧化镍所占的面积=2ɑ m×2ɑ m×sin60°,则每平方米含有的氧化镍个数=![]() ,每个氧化镍的质量=
,每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() ×
×![]() =
=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
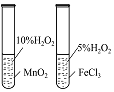
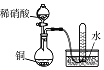
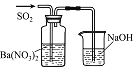
实验 目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D